点击蓝字 关注我们
揭秘人体肠道与口腔微生物的人际传播模式

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.98
● 2023年3月22日,荷兰格罗宁根大学傅静远团队在iMeta 在线发表了题为“Beyond personal space: Unveiling the transmission pattern of the human gut and oral microbiome ”的文章。
● 本文对 Nature 微生物菌株传播研究进行了评论。该研究整合了公开可用的和新测序的宏基因组数据,纳入了来自20个不同国家,涵盖800多个细菌物种,总数超过9700的样本,并分析评估了母亲-孩子、双胞胎、家庭成员、同居者、同一人群内的不同个体、以及不同人群间的个体之间的肠道和口腔微生物组在菌株水平上的共享情况。
● 第一作者:Sergio Andreu-Sánchez(安思晗)、吴佳斐
● 通讯作者:傅静远 ([email protected])
● 主要单位:荷兰格罗宁根大学医学中心遗传学系
亮 点
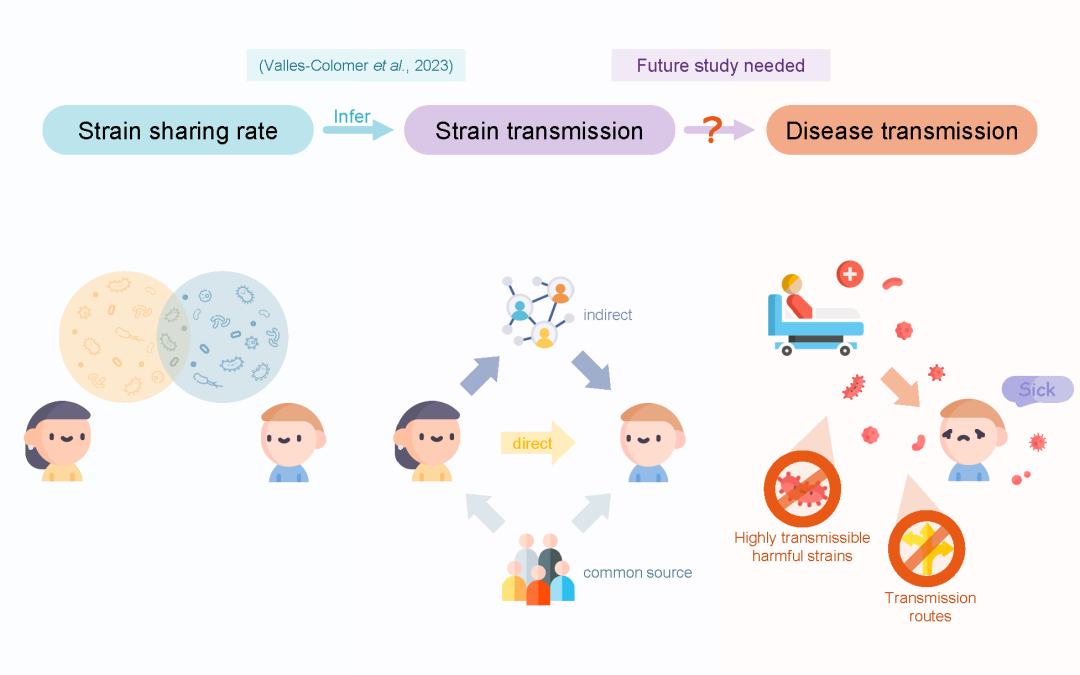
● Valles-Colomer等人的工作通过微生物菌株的共享率推断了人与人之间的微生物传播
● 共享菌株的存在并不一定表明个人之间存在菌株的直接传播
● 未来的研究应着重研究非传染性疾病通过微生物菌株传播的可能性
● 一旦确定具有高传播性的有害菌株和其传播途径,我们就可以制定有针对性的干预措施
全文解读
引 言
人体是一个微生物的乐园,无数不同功能、不同特性、不同形态的细菌在此繁衍生息。这些微生物在我们的生命过程中是如何定居到人体内的?人体内微生物的起源是微生物组学领域的一个基本问题,而我们对此还知之甚少。过去的研究显示,我们体内的大部分微生物都是从其他人那里获得的。在出生后不久,婴儿就接受了来自母亲的微生物垂直传播,从而开始建立持久的宿主-微生物共生关系,并对他们的免疫和认知发育产生深远影响。随着年龄增长,社会交往和居住环境也会显著改变人类微生物组的组成。对于进一步理解不同个人和群体之间微生物传播的程度和方式,大规模、菌株水平分辨率、在跨地域多种族队列中的研究是突破的关键。
最近发表在 Nature 杂志上的一篇文章是针对这个主题做出的迄今为止最大规模、最全面的研究。该研究整合了公开可用的和新测序的宏基因组数据,纳入了来自20个不同国家,涵盖800多个细菌物种,总数超过9700的样本,并分析评估了母亲-孩子、双胞胎、家庭成员、同居者、同一人群内的不同个体、以及不同人群间的个体之间的肠道和口腔微生物组在菌株水平上的共享情况。
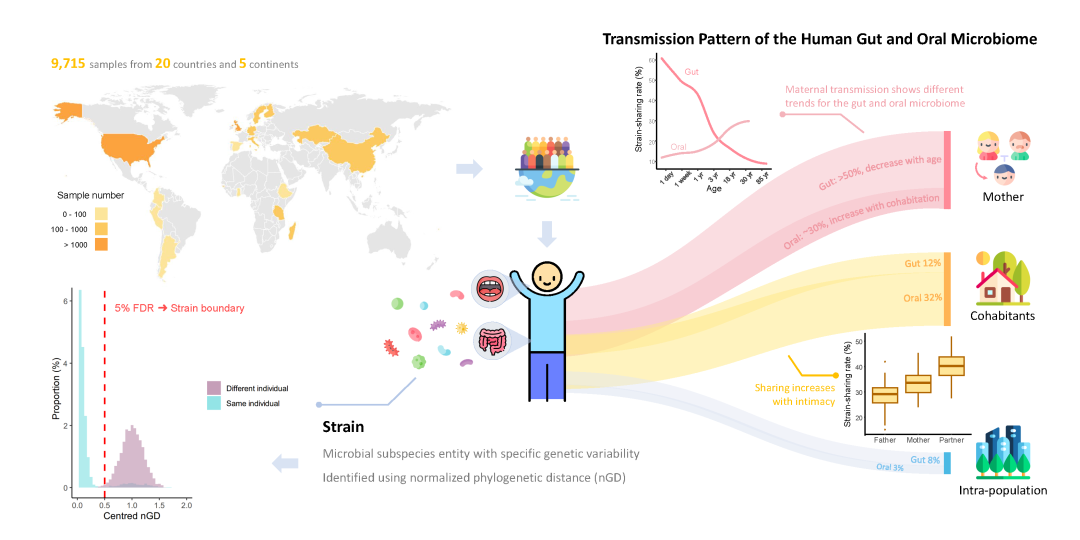
图1. 这张图总结了Valles-Colomer等人的研究。该研究包括了来自20个国家5个大洲的9,715个样本,呈现了全球范围的人类肠道和口腔微生物传播的概览。“菌株” 的定义方面,该研究使用了物种特异性的标准化系统发育距离 (nGD, normalized phylogenetic distance),将nGD的阈值设定为了能够将同一个人在不同时间的样本与不同个人间的样本区分开的最佳值。研究在肠道和口腔微生物组中都观察到了菌株的传播。个人与其母亲、同居者和同一人群中的其他人都存在菌株共享。母源传播在肠道和口腔微生物群中表现出不同的趋势。婴儿与母亲共享超过50%的肠道微生物菌株,随着年龄增长,共享率会随着孩子从外界获取新菌株的增加而降低。母亲与幼儿在早期的口腔微生物的共享率较低,但随着共同生活时间的增加,共享率也随之增加。个人和同居者的口腔微生物的共享率随着亲密度的增加而增加,与母亲-孩子相比,伴侣之间的共享率更高。图片中使用的一部分图标来自flaticon.com。
“菌株”的定义
要了解微生物的传播途径,就需要对一个物种内部具有特定遗传变异的“菌株”进行严格的追踪,从而揭示新的定殖者来自何方以及能够存活多久。在微生物组领域,“菌株”的概念尚无定论,但它通常被认为是一个亚种水平的分类单元。Valles-Colomer等人首先对此进行了技术革新,他们先是建立了646种肠道和252种口腔细菌物种的标记基因库,然后基于这些标记基因利用StrainPhlan4建立了主要菌株之间的系统发育关系,并以此设定了物种特异的归一化的系统发育距离(normalized phylogenetic distance)阈值来划分菌株。该阈值能够区分同一个体在不同时期(最长相隔6个月)所携带的菌株和其他样本中的菌株。虽然这个阈值是针对特定人群和进化时间而优化的,但它却是一个稳健有效的指标,作者们据此发现了一些不受研究对象、人群和技术差异影响的普适规律。
肠道和口腔微生物组的传播
该研究发现,肠道和口腔微生物组的传播十分普遍,并且主要取决于亲密接触和社会互动。
在肠道微生物组方面,母亲与婴儿通常共享最多的菌株(中位数34%),并且这种垂直传播在3岁后基本稳定,形成了一种长期持续的共享状态。随着年龄的增长,个体从其他来源获得新菌株导致其与母亲的菌株共享程度有所下降,但在成年且不与母亲共同居住的个人中仍能观察到母子之间较高水平的菌株共享,这可能是垂直传播的印迹效果,也可能是共同的社交关系带来的影响。同样,成年非同居的双胞胎中也观察到的共享菌株(中位数为8%)也可能是出于这两个原因。
共同居住的个人之间呈现出高比例的菌株共享,但不同家庭之间存在显著差异(11%-71%,中位数12%),这种共享规律似乎在不同地理位置和生活方式下的家庭中都比较一致。来自同一个村庄的不同个人也表现出一定程度的菌株共享(中位数8%),但这个比例远低于同一家庭成员之间的共享。人群内部的菌株传播在不同人群之间并不均匀,且受到人群特征的影响。
有唾液作为直接载体,口腔微生物组中能观察到的菌株共享程度比在肠道微生物组中更高,并且大多是水平传播。母亲与婴儿间的菌株共享率较低,而随着孩子与母亲共同生活的时间增加,共享的菌株数量也会随之增加。共同居住的个人之间的口腔菌株共享率(中位数32%)远高于同一人群中非同居个体(中位数3%)和不同人群(中位数为0%)之间的共享率。
最后,作者也发现了一些在被共享的细菌方面存在的普遍规律,比如革兰氏阴性菌在同居者和母子对之间更易传播,而能形成芽孢和耐氧的粪便菌则在人群内部更易传播。
未来展望
该研究对不同人群中肠道和口腔微生物的传播进行了全面评估,为该领域的未来研究奠定了重要基础。虽然这项工作已经涵盖了来自多个国家和大陆的数据,但进一步纳入研究不足的人群和探索更多的微生物物种将有助于推广他们描述的趋势。
尽管该研究发现了具有传播倾向的菌株的一些共同特征,但仍有许多问题有待解答。菌株在社交活动中的传播或许是随机发生的,但菌株在传播后能否成功定殖却因人而异,这一现象在粪便微生物组移植中也已被观察到。未来的研究应该着重阐明可能影响菌株可传播性的因素,包括菌株自身具备的功能特性,如抗生素耐药性或毒力因子等,以及宿主方面的因素,如受体微生物组构成上的差异等。此外,该研究的设计基于同一人群或家庭内成员具有相似生活方式的假设。尽管这种假设相对合理,未来的研究应可能收集更加广泛而详细的环境因素信息,尤其是疾病相关的风险因素和表型。
微生物组学的前沿将不断拓展,随着测序深度的增加、更高保真长读段的测序手段和更准确的菌株解析工具的开发,我们将有能力把那些更稀有的菌株也纳入分析。此外,能够捕捉人与人之间每个菌株的共享比例的新的分析方法的开发,将能进一步优化我们目前对“菌株共享率”的定义,并揭示个体内菌株随时间演变的动态和传播过程中菌株进化的趋势。
菌株共享并不一定意味着菌株在人与人之间存在直接传播。该研究虽然尽量排除了从饮食来源共同获得相同菌株的可能性,但不同个体仍可能从共同的社交网络或环境中分别获得同样的菌株。未来的研究应将人与人周围环境和社交网络的相关性及相似性也纳入考虑。要准确评估人际传播情况,利用物种特异性分子钟来估计进化速率和时间尺度将十分有力,能够让我们更好地理解菌株传播事件的频率和模式,并帮助探明观察到的人际传播是一对一,一对多,还是来自未知的共同第三方。
随着全球化程度的不断提高,跨国旅游和贸易活动日益频繁。国际旅行者可能会携带特定类型的菌株,并通过社交互动将这些菌株传播给其他人。通过分析外国访客及其密切联系人纵向样本中的分子钟,可以揭示人与人之间的传播途径。最终,这类研究可以帮助我们进一步理解微生物传播和进化背后的复杂动态。
对人类健康的启示
人类疾病通常被分为传染性和非传染性两类。传染性疾病,一般指有特定病原菌的疾病,可以通过人与人、动物与人或环境与人之间的接触而传播。比如最近全球肆虐的新冠肺炎就是一种典型的传染性疾病。非传染性疾病则无特定病原菌且被认为不会在个体间传播,它们包括了大多数慢性疾患,如心血管疾病、抑郁、癌症和糖尿病等。近年来的研究指出了微生物在这些慢性疾病发病中起着重要作用。如果我们能够评估疾病相关菌株在母婴传播和人际传播中的频率,以及菌株的传播对疾病发展的影响程度,“非传染性疾病”的定义将可能会被颠覆。
目前已经发现了一些微生物传播途径,其中最常见的是肠道-食物-口腔-肠道途径。如果疾病风险可能通过微生物传播,那么有效地防止疾病相关微生物被传播的适当措施就必不可少。比如,建立商超餐馆等处食物来源的监测计划。另一方面,如果我们能够发现与慢性疾病特征相关、且容易传播的微生物菌株,我们就可以制定有针对性的干预措施,以降低它们在人群中传播的可能性,或者只让有益健康的微生物菌株传播。相应的预防或干预措施对于高风险人群尤为重要,例如,我们或许可以重新审视目前在精神病院或养老院被普遍采用的共同居住模式。
人类微生物组是一个神秘而广阔的领域,它包含了我们身体内所有微生物及其遗传信息。这些微生物对我们健康有着重要的影响,但我们还不清楚它们是如何被获得和构建的,以及我们该如何通过改变生活方式和采取临床干预措施来培养更健康的微生物组。通过确定个体间微生物组传播的程度和模式,我们可以更好地理解微生物组在疾病发展中的作用,并可能开发出改善健康结果的干预措施。Valles-Colomer及其同事们的工作帮我们在这条道路上迈出了重要的第一步。
引文格式:
Sergio Andreu-Sánche, Jiafei Wu, Jingyuan Fu. 2023. Beyond personal space: Unveiling the transmission pattern of the human gut and oral microbiome. iMeta e98. https://doi.org/10.1002/imt2.98
作者简介

Sergio Andreu-Sánchez(第一作者)
● Sergio Andreu-Sánchez(西班牙人),中文名安思晗,格罗宁根医学中心遗传学系博士生
● 主要研究方向是肠道微生物组在免疫系统和衰老中的作用

吴佳斐(第一作者)
● 吴佳斐,格罗宁根医学中心遗传学系博士生
● 主要研究方向是肠道菌群与人类睡眠行为之间的双向作用

傅静远(通讯作者)
● 荷兰格罗宁根大学系统医学教授
● 研究领域包括宿主和肠道菌群在代谢及免疫的相互作用,以及对人体健康的影响。研究项目涉及大数据群体水平研究,例如荷兰LifeLines 项目,跟踪分析近17万个体30年,分析遗传,饮食,环境,肠道菌群及社会经济因素对疾病和性状的影响,以达到个体化、精准化医疗
更多推荐
(▼ 点击跳转)
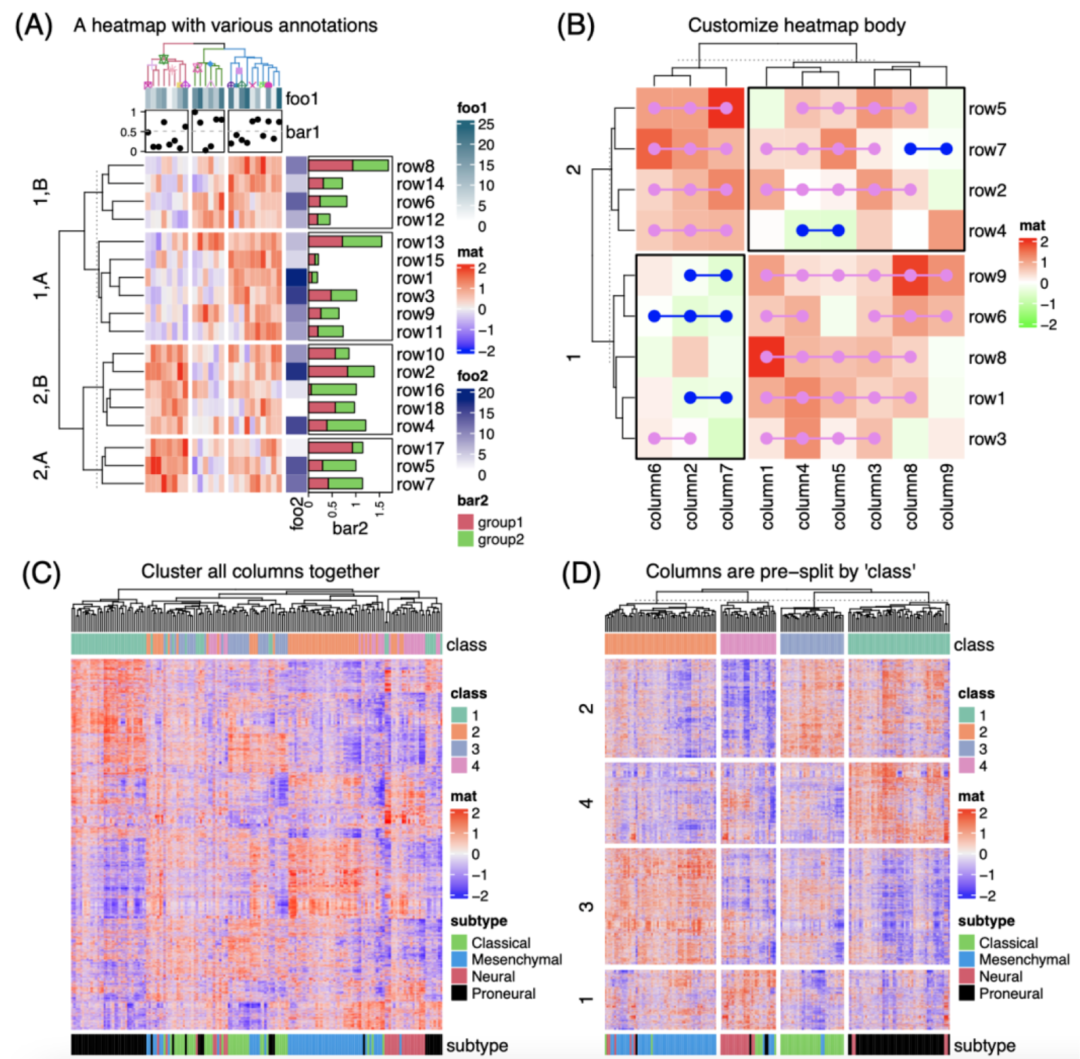
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
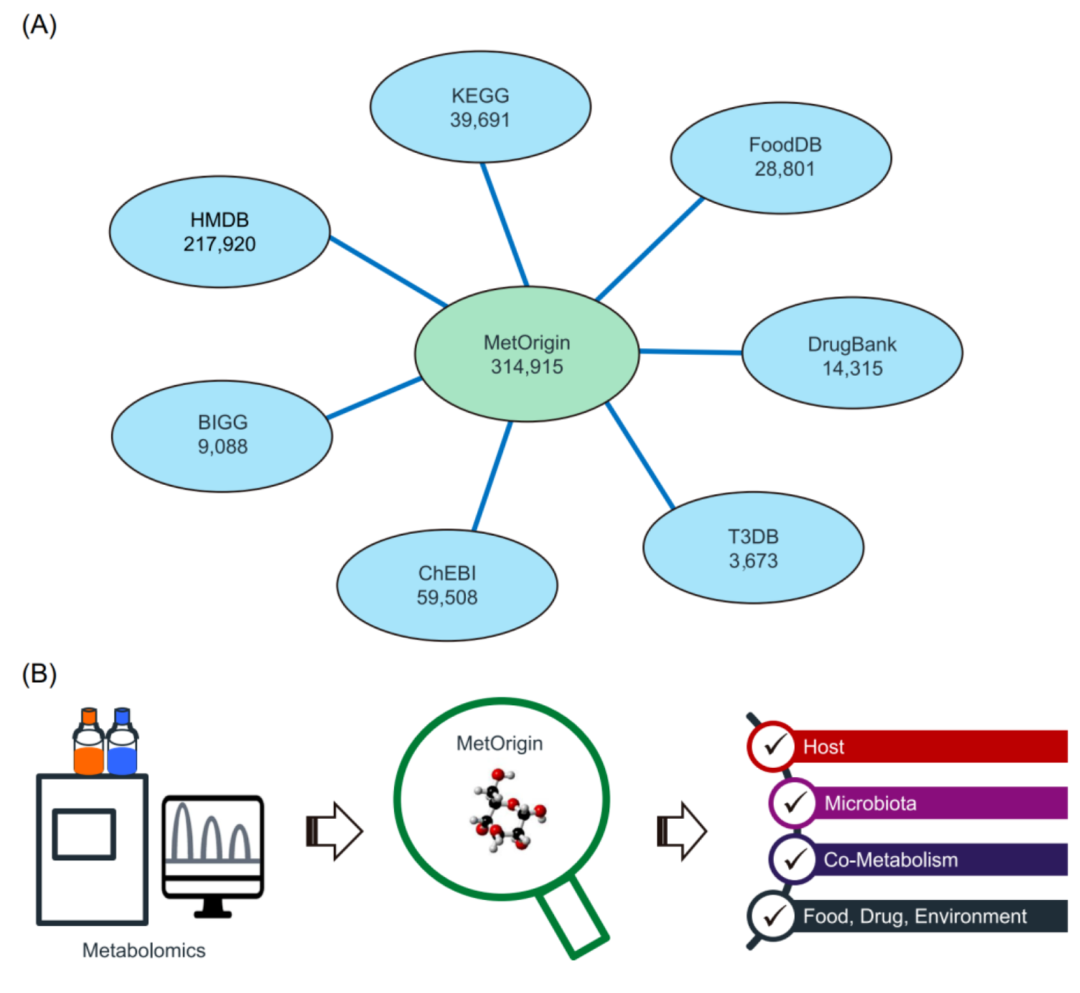
iMeta | 浙大倪艳组MetOrigin实现代谢物溯源和肠道微生物组与代谢组整合分析
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:[email protected]