点击蓝字 关注我们
基于多组学整合的妊娠期糖尿病精准营养:
Westlake Precision Birth Cohort研究方案

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.96
● 2023年3月15日,西湖大学生命科学学院郑钜圣团队、杭州市妇产科医院胡文胜团队联合在 iMeta 在线发表了题为 “Integration of multiomics with precision nutrition for gestational diabetes: Study protocol for the Westlake Precision Birth Cohort ” 的文章。
● WeBirth(Westlake Precision Birth Cohort)是一项基于~2000名妊娠糖尿病孕妇及其子代的前瞻性出生队列。队列收集多类信息和生物样本,使用可穿戴设备进行连续血糖监测和体力活动记录,并在研究设计中加入了标准膳食试验。本研究主要目标是通过整合饮食摄入、连续血糖表现、体力活动监测和多组学数据,研究妊娠期糖尿病女性的精准营养。
● 第一作者:梁新袖
● 通讯作者:郑钜圣([email protected])、胡文胜([email protected])
● 合作作者:苗泽蕾、卢莎、叶萌、王佳丽、赵慧、肖丛梅、帅梦雷、苟望龙、梁玉慧、许凤喆、史美琪、吴瑛瑛、汪旭红、蔡峰城、徐萌艳、付元庆
● 主要单位:西湖实验室智能生物标记物核心实验室、西湖大学生命科学学院、杭州市妇产科医院
亮 点
● WeBirth(Westlake Precision Birth Cohort)是一项基于~2000名妊娠糖尿病孕妇及其子代的前瞻性出生队列
● 队列收集多类信息和生物样本,使用可穿戴设备进行连续血糖监测和体力活动记录,并在研究设计中加入了标准膳食试验
● 我们的主要目标是通过整合饮食摄入、连续血糖表现、体力活动监测和多组学数据,研究妊娠期糖尿病女性的精准营养
摘 要
WeBirth(Westlake Precision Birth Cohort)是一项基于妊娠糖尿病(GDM)孕妇及其子代的前瞻性出生队列。WeBirth旨在研究GDM患者(n~2000)的精准营养,通过结合标准化膳食测试和连续葡萄糖监测来反应参与者对膳食摄入的个性化血糖响应。参与者将在入组时(孕24 ~ 28周)接受14天的连续血糖监测和客观体力活动测量,并在此期间食用三个标准餐(早餐、早加餐、中餐)。同时,我们通过在线应用程序收集参与者这14天的饮食记录。我们将在妊娠晚期、分娩期间及产后对参与者进行随访。本研究收集有关人口统计、生活方式、饮食习惯、疾病史和心理健康等信息,以及血液、唾液、尿液、粪便、胎盘和母乳等生物样本;并将进行多组学检测(如粪便宏基因组、代谢组和蛋白质组)及各类数据的整合分析。WeBirth通过在GDM人群中整合精准营养、可穿戴设备和多组学数据等,为前瞻性出生队列研究提供了一个新的思路和框架。
视频解读
Bilibili:https://www.bilibili.com/video/BV1hV4y197r5/
Youtube:https://youtu.be/23w-zGsvD8Q
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
妊娠期糖尿病(GDM)是一种常见的妊娠并发症,近年来在世界范围内的发病率呈上升趋势。尤其在一些亚洲和非洲国家,GDM的患病率已经超过了20%,造成了巨大的医疗和经济负担。患有GDM的女性发生短期和长期并发症的风险增加,如妊娠期高血压疾病、会阴创伤和2型糖尿病(T2D)等。同时,母体血糖耐受不良可促进胎儿葡萄糖摄入,进一步提高了大于胎龄儿(LGA)或巨大儿、新生儿低血糖的发病率,及子代在儿童或远期代谢综合征的风险。
生活方式干预(包括营养和体力活动)是GDM的一线治疗方法。妊娠期的营养状况对妇女自身及其子代的健康状况都有着重大的影响。众所周知,不同个体对相同的饮食或营养暴露可能有不同的响应。例如,在非妊娠人群中,不同个体对相同食物的餐后葡萄糖响应是截然不同的。然而,到目前为止,GDM人群饮食/营养干预的个性化血糖反应及其与出生结局的关系尚未被研究。在此,我们还总结了全球40多个前瞻性出生队列的基本情况,主要包括样本量、优势和局限性等(补充表S1)。正如我们所看到的,这些出生队列通常纳入大样本量的普通孕妇(非专病队列),同时缺乏精细的多组学测量。
了解孕妇对不同饮食的个性化血糖反应,有助于为GDM建立精准的饮食营养建议,从而进一步改善这些孕妇及其后代的健康。新兴的连续血糖监测技术(continuous glucose monitoring, CGM)使我们能更方便地监测血糖波动、餐后血糖响应、高血糖和低血糖状态、以及血糖变异。因此,我们建立了一个基于GDM孕妇的前瞻性出生队列(Westlake Precision birth cohort, WeBirth),整合了包括CGM在内的可穿戴设备,使用Axivity AX3加速计对体力活动进行客观测量,并在参与者中收集多组学数据。同时这些参与者会在基线时食用几个标准餐食,以检测她们对饮食的个性化反应。我们的主要目标是从精准营养的角度探索GDM患者的最佳饮食营养建议,及其个性化血糖反应与妊娠结局之间的关联。
队列设计
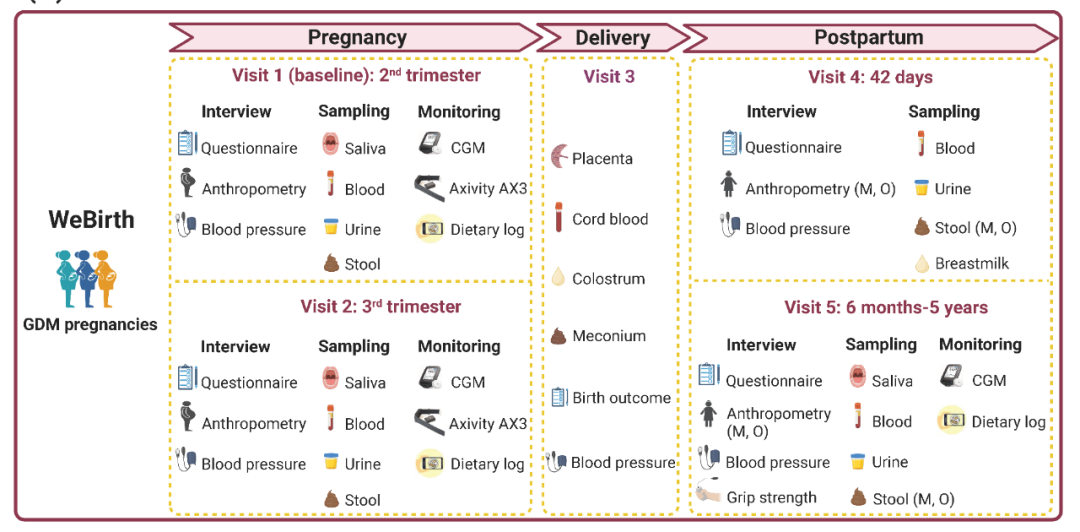
WeBirth是一项于杭州进行的前瞻性队列研究,研究对象是患有GDM的孕妇及其子代。图1A为研究设计的概述。在WeBirth中,我们整合了三个独特的部分:1)使用Axivity AX3加速计(Axivity Ltd, Newcastle, UK)客观测量怀孕期间的体力活动;2)使用饮食频率问卷(FFQ)和饮食日志/记录评估膳食摄入情况;3)使用CGM (Freestyle Libre Pro)连续监测14天的血糖水平,并在此期间给受试者进行标准餐测试。
WeBirth的主要目的是研究:
1)GDM患者对日常膳食摄入和体力活动的连续血糖反应,并促进GDM的个性化营养/生活方式推荐的制定;
2)妊娠期间膳食摄入、体力活动及连续的血糖响应特点与不良分娩结局的关系,如早产、低出生体重(或小于胎龄儿)、以及巨大儿(或大于胎龄儿)。
WeBirth的次要目的是探究:
1)妊娠期间的CGM与GDM母亲产后体成分、子代在儿童早期体重变化的前瞻性关联;
2)GDM妇女分娩后发生2型糖尿病的危险因素(例如,连续葡萄糖特征、饮食习惯、以及口腔和肠道菌群)。
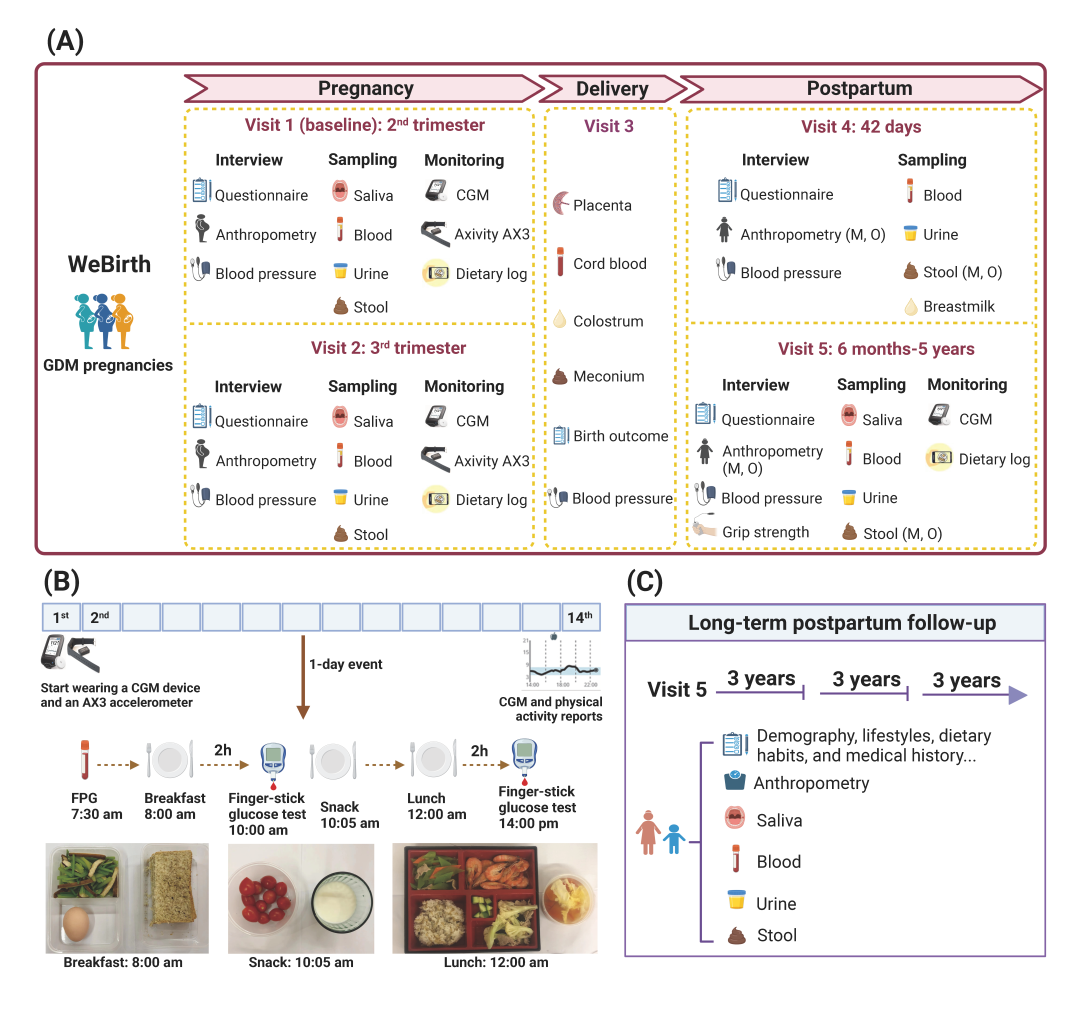
图1. WeBirth 研究设计
(A)研究设计概述。(B)一日门诊日程和标准餐。(C)长期纵向随访。
基线招募
我们的计划样本量(n = 2000)主要是参考基于多组学研究精确营养的主流研究文献。WeBirth的招募是对象是在杭州市妇产科医院(杭州市妇幼保健院)进行产前检查的孕妇,正式的招募工作从2019年8月开始。纳入和排除标准如下:
纳入标准
1)18岁或以上的孕妇;
2)被诊断为GDM的孕妇,孕周主要在24 ~ 28周;
3)计划在杭州市妇产科医院分娩;
4)计划携本次妊娠产下的子代在杭州居住≥4年的孕妇。
排除标准
患有癌症或其他严重疾病的孕妇。
在常规产检过程中,孕龄在24-28周的孕妇需进行2小时75克口服葡萄糖耐量试验(OGTT)。我们采用国际糖尿病和妊娠研究组协会(IADPSG)的标准来诊断GDM(空腹血糖[FPG]≥5.1 mmol/l,和/或1小时血糖≥10.0 mmol/l,和/或2小时血糖≥8.5 mmol/l)。
我们的参与者是由营养科医生推荐的。孕妇确诊为GDM后,在产科医生的建议下到营养科进行营养咨询。营养科医生对这些孕妇进行初步筛选,排除那些不愿佩戴CGM设备或依从性极差的孕妇后,推荐其余的孕妇到队列的招募诊室。训练有素的队列工作人员进一步评估她们的情况和参与意愿。GDM诊断与入组本研究之间的时间间隔中位数为0天(四分位数[Q]1 = 0; Q3 = 6)。工作人员对受试者进行面对面访谈,通过问卷收集人口统计学信息、生活方式、饮食习惯、体育活动、职业史、用药史和家族疾病史等信息。骨密度和体成分分别使用超声骨密度计(Sunlight MiniOmni, BeaMed Co,以色列)和InBody 720(Biospace Co. Ltd,首尔,韩国)进行评估。每位参与者都佩戴CGM设备和AX3加速度计,以分别进行14天的连续血糖和体力活动监测。我们随机选择一些参与者,给她们同时在两只手臂上佩戴CGM,以检验读数的稳定性。参与者在佩戴CGM和加速度计的期间,用在线程序记录饮食摄入量和营养补充剂的情况(同时附图片),作为电子饮食日志。同时,参与者在招募时使用24小时膳食回顾(24 HR)报告其前一天的食物摄入量。基线收集的生物样本有唾液、血液、尿液和粪便。
标准餐测试
作为杭州市妇产科医院对高血糖孕妇的常规健康咨询,所有参与者都被邀请参加为期1天的饮食和生活方式调整活动/课程(“一日门诊”),以指导孕妇管理血糖状态(图1B)。标准餐由营养科医生根据中华人民共和国国家卫生健康委员会《妊娠期糖尿病患者膳食指南》(WS/T 601-2018)制定,并由医院员工食堂准备。早餐的食材包括鸡蛋、全麦粉、芹菜和豆腐;早加餐包括西红柿和脱脂牛奶;午餐包括米饭、燕麦、虾、生菜、瘦肉、胡萝卜、黑木耳、西兰花、黄瓜和番茄蛋花汤(图2A)。在一日门诊当天早晨,我们将抽取参与者的空腹血(禁食≥8小时),以检测FPG、HbA1c和维生素D水平。随后,我们组织所有参与者到医院的一个特定区域内,食用标准化的早餐、早加餐和午餐;并分别在早餐和午餐后2小时检测其指尖血糖水平。同时,由特定的护士/医生在两餐之间为参加者讲授孕期相关的健康知识。
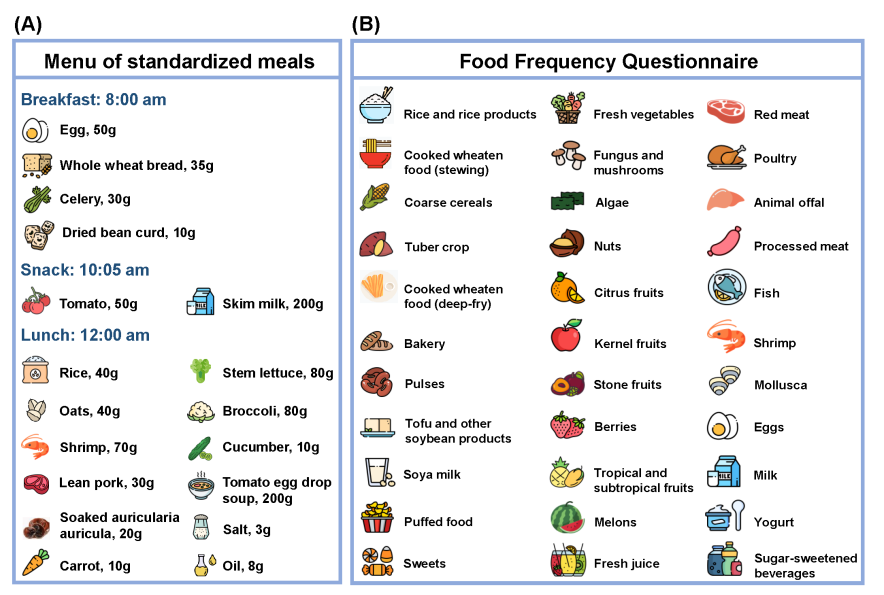
图2. 标准餐(A)及饮食频率问卷(B)的食物条目
随 访
我们在妊娠晚期、分娩期间和产后分别对参与者进行随访(图1A)。妊娠晚期(visit 2)的随访发生在孕妇来医院进行产检时,本次随访主要通过问卷调查的方式收集睡眠质量和心理健康方面的信息。同时,收集参与者的血压、体重、CGM、体力活动和24小时膳食回顾情况等;并采集与基线相似的生物样本。在分娩期间(visit 3),我们通过电子病历获得有关分娩结局的信息(例如,分娩时的胎龄、出生体重、身长、及其他围产期医疗信息等),并采集胎盘、脐带血、胎粪和初乳等生物样本。
产后42天的随访(visit 4)是在参与者到医院进行产后护理时进行开展的,主要通过问卷调查收集母亲产后心理健康状况、婴儿喂养和生长发育等信息。由于新冠肺炎疫情,以及当地偶尔的病毒爆发和政府管控,我们计划对参与者进行产后家访的计划被严重打乱。因此,我们原计划的随访时间(产后6 ~ 18个月),需要修改为相应的产后6个月~ 5年(visit 5)。访问5分为家访和医院访随访两部分。在家访期间,参与者通过填写问卷,报告自己和子代的饮食习惯、生活方式和疾病史等信息。这些母亲将再次佩戴CGM设备14天,同时使用在线程序记录每天的饮食摄入量。这些参与者的体检和生物样本采集将在杭州市妇产科医院体检中心进行。其子代的体格检查等将被邀请到浙江大学医学院附属儿童医院进行。我们会根据这些孩子的年龄进行不同的发育筛查,比如听力筛查。
虽然我们会尽最大努力对这些参与者进行随访,但在队列研究中,失访仍然是一个大问题。因此,我们将尝试通过不同的策略鼓励这些参与者回到研究中心,例如设置专门的健康咨询课程和免费的母亲和孩子健康检查等。
由于GDM孕妇在分娩后患T2D的风险较高,且其子代在远期患有心血管代谢性疾病的可能性增加,因此我们将每三年一次,继续纵向随访这些参与者及其子代(图1C)。在产后长期随访中收集与visit 5时相似的信息和生物样本。长期随访也将包括两个部分:家访和医院随访。在家访期间,我们将通过问卷收集母亲和子女的饮食习惯、生活方式和疾病史。此外,母亲和子女的体格检查将在医院进行。
问卷调查
我们主要通过问卷调查收集有关人口统计学、生活方式、饮食习惯、体力活动、职业史、医疗和家庭疾病史、婴儿喂养情况以及生长发育情况等数据(图3;详细信息见表1)。除收集基线时医疗和家族病史信息的问卷外,其余问卷均为参与者在面对面访谈期间完成。我们设计了一份饮食频率问卷(FFQ,图2B),包含33个食物/食物组分,以收集参与者的饮食习惯。在FFQ问卷设计中,我们考虑了饮食习惯的区域特征(中国长三角地区)和并参考相关中国队列的现有饮食频率问卷,包括广州营养与健康研究。我们分别采用中文版《孕期身体活动问卷》(PPAQ-C)和《国际身体活动问卷长卷》(IPAQ-LC)对被试孕期和产后的体力活动进行评估。采用中文版匹兹堡睡眠质量指数(CPSQI)评估受试者多个维度的睡眠质量。此外,我们利用中国版本的自我评估焦虑量表(SAS),自我评估抑郁量表(SDS),妊娠相关焦虑问卷(PRAQ),正负情绪量表(PANAS),爱丁堡产后抑郁量表(EPDS)和中文版营养食欲问卷(CNAQ)进行社会心理特点的评估,包括焦虑、抑郁、心情(或情绪)和食欲等。所有问卷均通过在线平台(“问卷星”,长沙冉星科技,中国长沙)构建,附带数据缺失或异常数据的自动预警。
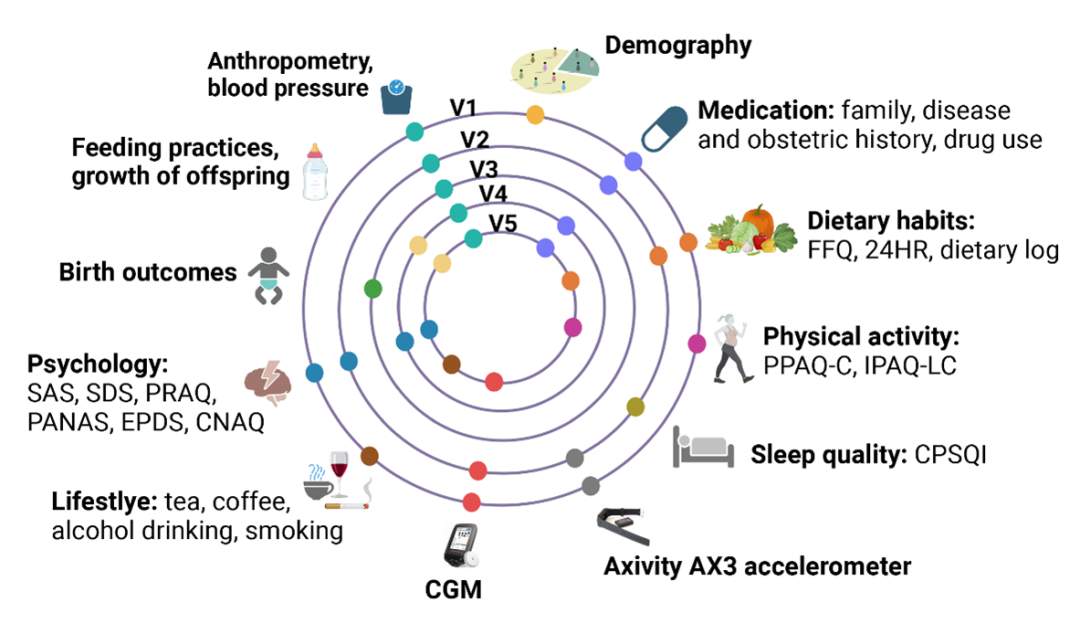
图3. 队列各个阶段的信息收集
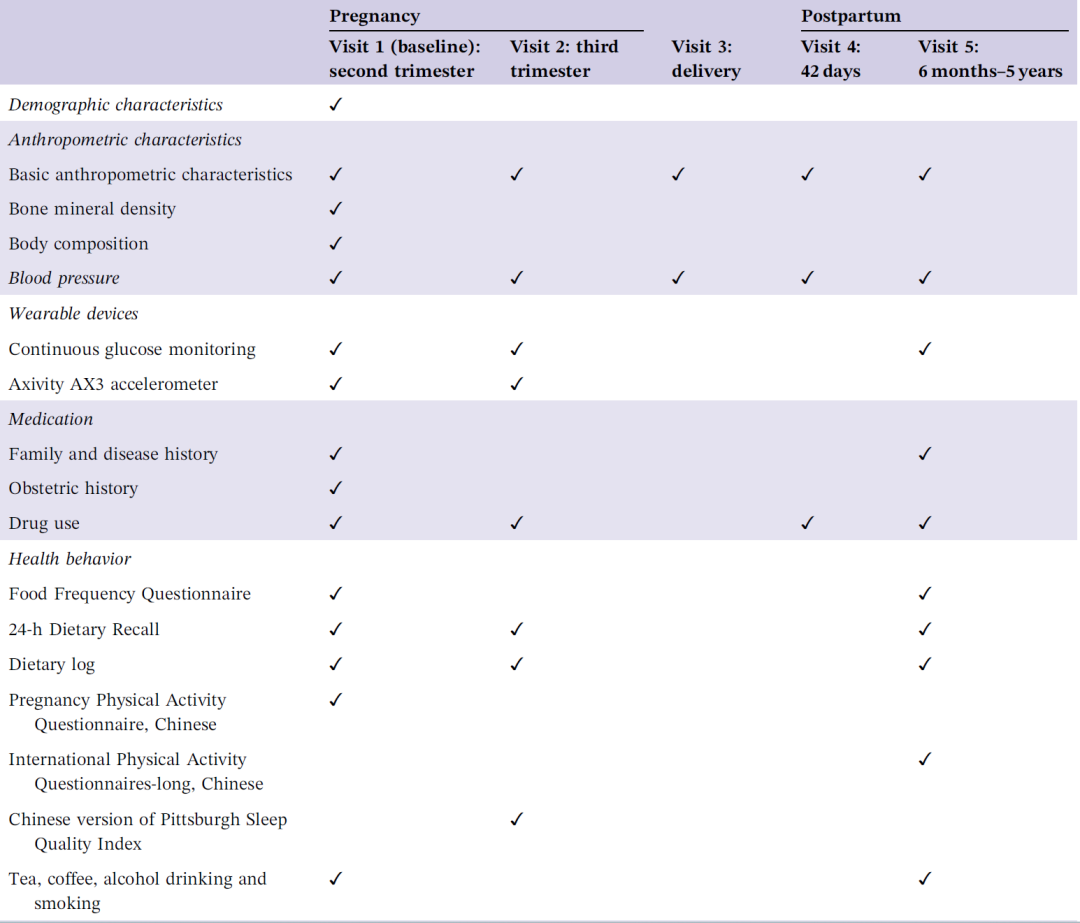
表1. 队列信息收集

生物样本的采集和保存
图1提供了WeBirth在不同时间点生物样本的采集情况。唾液样本在医院(visit 1, 2)或家中(visit 5)使用带有DNA保护液的试管收集,并在采集后的10小时内转移到-40°C冰箱保存。参与者需要在进食、饮水、吸烟或咀嚼后等待至少30分钟,并喝一些水清洁口腔,之后才能进行采集唾液样本的采集。
妊娠期间的粪便样本均在医院采集,并在1h内分装冻存到-40°C冰箱。粪便样本以三种形式保存,包括原始粪便样本、混合了RNA保护液的粪便、以及混合了50%甘油的粪便。胎粪和初乳在分娩后3天内收集,采集后暂时保存在4°C,并在15小时内转移到-40°C冰箱。对于产后随访,母亲或其子代的粪便样本在家中用带有DNA保护液的试管来采集,在收集后的3天内(室温)转移到实验室进行分装并保存在-40°C冰箱。中段尿和母乳样本均在医院收集,立即放置于4°C,并在收集后3小时内分装放置于-40°C冰箱保存。
所有血清样本和大部分全血样本在禁食至少8小时后采集(妊娠晚期全血样本为随机采样)。所有的血样采集后暂时保存在4°C下。随后,我们将血浆、白细胞、红细胞和血清样本分装并保存在-40°C的冰箱中。脐带血样本由护士在产房使用K2EDTA管收集。胎盘样本来自胎盘胎儿面,距离脐带1厘米范围内的两个1 cm3的胎盘。脐带血和胎盘样品采集后立即保存在4°C冰箱,并在采集后的24小时内分装并冻存在-40°C冰箱。另外,胎盘样品分装保存需加入DNA保护液。
上述所有生物样品均在医院-40℃临时冷冻。在采集后的一个月内,我们将所有的生物样本用干冰转运到西湖大学,并保存在-80°C冰箱。
生物样本检测方法
对于血液样本,由医院检验科的自动设备评估常见临床生物标志物,如细胞类型和计数、血糖、血脂,以及反映肝肾功能、胆囊和甲状腺功能的标志物。此外,部分参与者的血液样本已根据现有标准流程进行基因组和蛋白质组检测。关于基因组检测,我们使用TIANamp®血液DNA试剂盒(DP348,天根生物科技有限公司,中国)从血凝块或白细胞中提取DNA。DNA浓度由Quit量化系统(Thermo Scientific, Wilmington, DE, USA)进行测定。提取的DNA储存在- 80°C,直到进一步评估。我们使用包含70万个位点的Illumina ASA-750K阵列进行基因分型,并使用PLINK1.9进行质量控制和相关性筛选。血清蛋白质组采用SWATH-MS方法进行检测。在TripleTOF 5600系统(SCIEX, CA, USA)上,结合Eksigent NanoLC 400 58System(Eksigent,都柏林,CA, USA)上,经过20分钟线性LC梯度,将多肽从蛋白质中消化,清洗,然后用SWATH-MS分析。
唾液和粪便样本主要用于微生物组检测,包括16S rRNA基因测序、宏基因组和ITS2测序。我们搭建了微生物组检测操作流程。根据说明,使用QIAamp®DNA Stool Mini Kit(Qiagen, Hilden, Germany)提取粪便DNA;DNA质量用1%琼脂糖凝胶电泳测定;所有DNA样本保存在-20°C冰箱直到测序。16S rRNA基因测序,我们使用hermocycler PCR系统(GeneAmp 9700, ABI, USA),扩增微生物基因组DNA中的16S rRNA V3-V4高变区,引物为338F: ACTCCTACGGGAGGCAGCAG;806R: GGACTACHVGGGTWTCTAAT由。PCR反应按以下程序进行:95℃变性3 min, 95℃30s 28个循环,55℃退火30s, 72℃延伸45s, 72℃最终延伸10 min。真菌ITS2高变区用引物ITS3F: GCATCGATGAAGAACGCAGC;ITS4R: TCCTCCGCTTATTGATATGC热循环PCR系统(GeneAmp 9700, ABI, USA)进行扩增。PCR反应按照下列程序进行:3分钟95°C的变性35周期30s在95°C, 30s的退火55°C和45s伸长72°C,和最后一个扩展在72°C 10分钟。根据Illumina MiSeq 平台(Illumina, San Diego, USA)标准操作规程将纯化后的16s rRNA或ITS2扩增片段构建PE 2*300的文库。
对于宏基因组检测,我们根据OMEGA Mag-Bind Soil DNA Kit(M5635-02) (OMEGA Bio-Tek, Norcross, GA, USA)提取粪便DNA。提取的DNA的浓度和纯度分别使用Qubit™4荧光计,WiFi: Q33238(Qubit™Assay Tubes: Q32856;Qubit™1X dsDNA HS Assay Kit: Q33231)(Invitrogen, USA)和琼脂糖凝胶电泳进行检测,并保存在-20°C冰箱以待进一步评估。根据Illumina TruSeq Nano DNA LT Library Preparation Kit对提取的微生物DNA进行处理,构建插入基因片段为400 bp的宏基因组鸟枪测序文库。每个文库由Illumina NovaSeq平台(Illumina,美国)在Personal Biotechnology有限公司(中国上海)采用PE150策略进行测序,每个样本至少有10GB的原始数据。
统计分析计划
我们将采用适当的统计方法分析和展示描述性数据。CGM读数将被处理以生成不同的血糖指标,如在目标范围内/高于目标范围/低于目标范围的时间百分比,曲线下的葡萄糖面积、变异系数等。我们将使用回归分析估计CGM衍生的血糖特征与饮食摄入量、体力活动和出生结局的关系。
对于基因分型数据,将通过SHAP EIT将变体映射到1000个基因组第Phase 3 v5。全基因组基因型填补将由Minimac3使用1000个基因组Phase 3 v5参考面板进行。我们将使用GCTA中的GREML方法来估计所有SNP解释的方差比例。我们将进一步基于基因组学和蛋白质组学数据对顺式蛋白数量性状位点(pQTL)进行共定位分析。
对于微生物组分析,我们使用用Kruskal-Wallis检验或回归分析比较不同研究分组之间α-多样性指数的差异,如Shannon指数(群落多样性的定量衡量)、observed features (群落丰富度的定性衡量)和Gini-Simpson指数(或Simpson指数,群落均匀度的衡量)。物种水平的分析将采用MaAsLin或多元回归。
我们采用非线性降维,如一致的流形逼近和投影以进行降维或主成分分析,来对每个组学数据集中进行降维;并使用相关分析、回归分析、机器学习(如Light Gradient Boosting Machine)和通路富集分析对不同组学数据集进行进一步的集成分析。
基线人口学特征
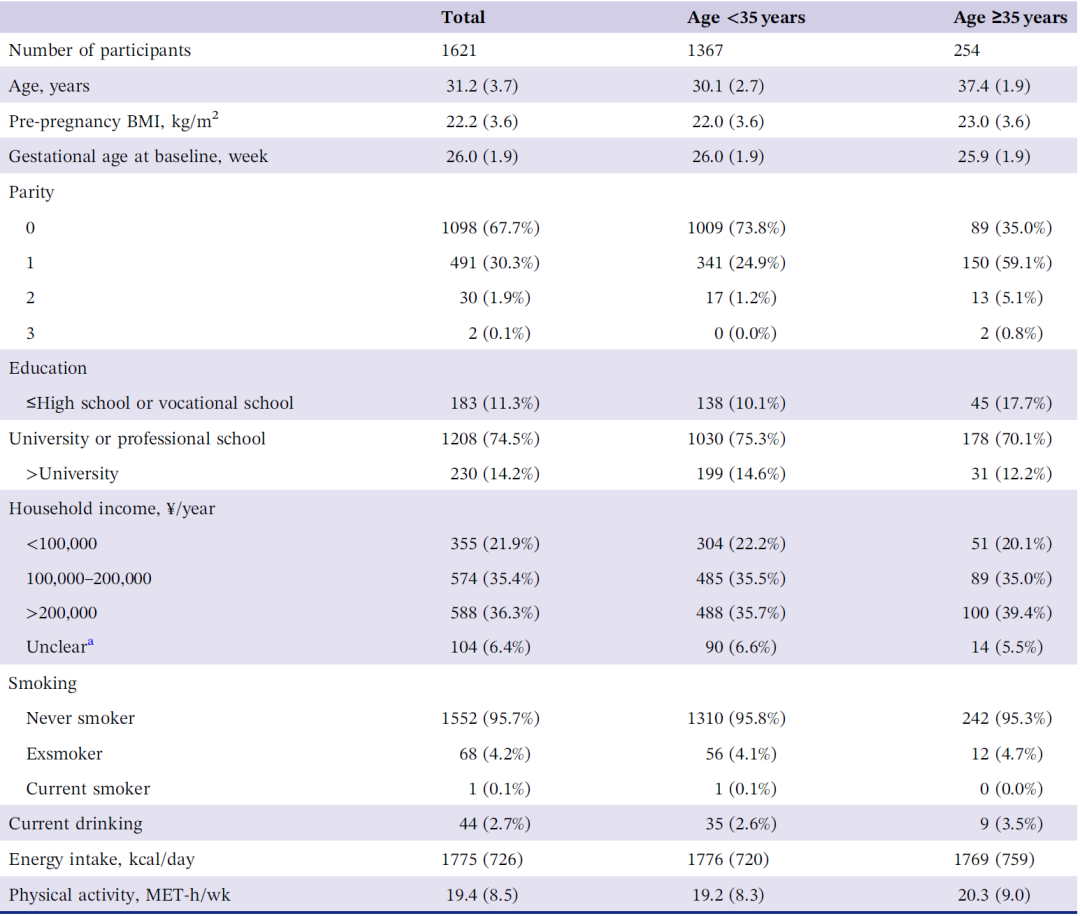
截至2022年10月,WeBirth纳入了1715名患有GDM的孕妇。在这些参与者中,1621人具备如下表所示的基本特征数据(表2)。参与者年龄分布在21 - 44岁之间(均值=31.2,标准差=3.7),其中15.7%的参与者(254 / 1621)年龄≥35岁。平均孕前体重指数和入组时的平均孕龄分别为22.2±3.6 kg/m2和26.0±1.9周。一半以上的孕妇(67.7%)是初产妇。大部分参与者(95.7%)从不吸烟。只有2.7%的参与者当前是饮酒者(定义为在过去一年中平均每月至少饮用一次含酒精的饮料)。根据FFQ,这些参与者的平均每日膳食摄入量为1775千卡(标准差=726)。
表2. 基本人口学特征
优势和局限性
WeBirth是一项正在进行的基于2000名GDM孕妇及其子代的前瞻性队列研究。参与者接受标准化的测试餐,连续14天的客观体力活动测量和连续血糖监测,并及时记录期间的饮食情况。我们采用了严格的质控标准:质量控制贯穿整个研究,以确保高质量的数据收集;如前所述,我们设置了对缺失数据或问卷值极端值预警;生物样本的收集、分装和检测遵循标准化的流程;饮食习惯与体力活动信息的收集采用不同的方法(饮食习惯:FFQ、24HR和饮食记录;体力活动:PPAQ-C、AX3加速度计)进行收集,可相进行相互验证;此外,在一日门诊时测量的FPG,及同时在部分受试者的两只手臂上佩戴CGM装置,可以检验CGM读数的稳定性和质量。独特的研究设计使我们能够探索GDM孕妇对膳食营养和体力活动的个性化血糖反应。同时,该研究的深度表型描述了不同维度的个人特征图谱,包括身体测量、生活方式因素、心理社会特征、医疗记录、临床生物标志物和多组学图谱。
本研究存在一定的局限性。首先,我们的队列是基于中国人,因此研究结果可能并不完全适用于其他国家或种族。其次,我们的研究只包含了患有GDM的参与者,目前缺乏正常对照组。最后,由于队列研究属于观察性研究,我们无法根据目前的队列数据建立因果关联。
总之,WeBirth为前瞻性出生队列研究提供了一个新的思路,在GDM孕妇中整合精准营养、可穿戴设备和多组学数据。来自WeBirth的数据将是一个独特的资源,有助于我们了解GDM人群的精准营养、不良妊娠结局风险因子、以及影响GDM孕妇及其后代长期健康的因素。
代码和数据可用性
在此阶段,大部分数据尚未进行检测。如需相关数据,请联系本文通讯作者(郑钜圣)。补充资料(图表、表格、脚本、图形摘要、幻灯片、视频、中文翻译版本和更新材料)可在线上DOI或iMeta Science http://www.imeta.science/中找到。
引文格式:
Xinxiu Liang, Zelei Miao, Sha Lu, Meng Ye, Jiali Wang, Hui Zhao, et al. 2023. Integration of multi-omics with precision nutrition for gestational diabetes: study protocol for the Westlake Precision Birth Cohort. iMeta e2: 96 https://doi.org/10.1002/imt2.96
作者简介

梁新袖(第一作者)
● 浙江大学和西湖大学联合培养博士生
● 主要研究方向为肠道菌群在糖代谢异常与认知功能障碍中的作用和机理

郑钜圣(通讯作者)
● 西湖大学生命科学学院 独立课题组负责人(PI)、特聘研究员、博士生导师
● 2009年毕业于宁波大学,获得学士学位;2014年毕业于浙江大学,获得博士学位,从事营养流行病学研究;2011-2012年,作为联合培养博士生,在美国塔夫茨大学人类老年营养研究中心从事营养遗传学研究;2015年-2018年在英国剑桥大学临床医学院从事遗传流行病学和营养学博士后研究工作,欧盟玛丽居里学者(Marie Skłodowska-Curie Individual Fellow)。2018年9月加入西湖大学生命科学学院,致力于精准营养与计算医学等领域的跨学科研究

胡文胜(通讯作者)
● 医学博士,主任医师,硕士生导师,杭州市妇产科医院副院长,杭州市重点学科产科学科带头人,杭州市政府特殊津贴人员,获“中国医师奖”、“杭州市三八红旗手”等荣誉称号
● 从医三十余年,作为知名产科专家,擅长产科合并症及并发症的诊断和处理。目前致力于孕妇及子代相关疾病的病因、发病机理、并发症处理等系列研究,对胎源性疾病的防控及干预积累了扎实的研究基础和大量的实践经验
更多推荐
(▼ 点击跳转)
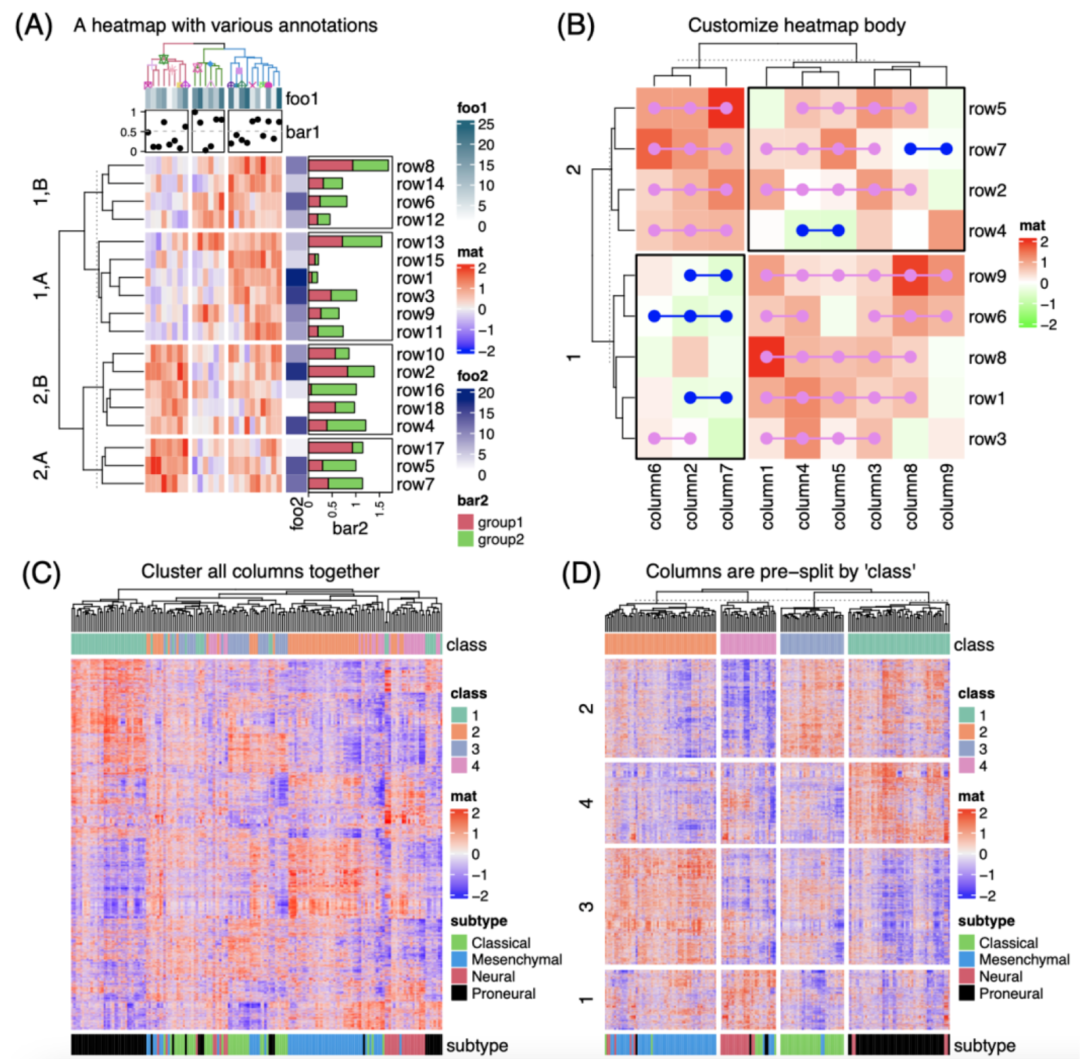
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
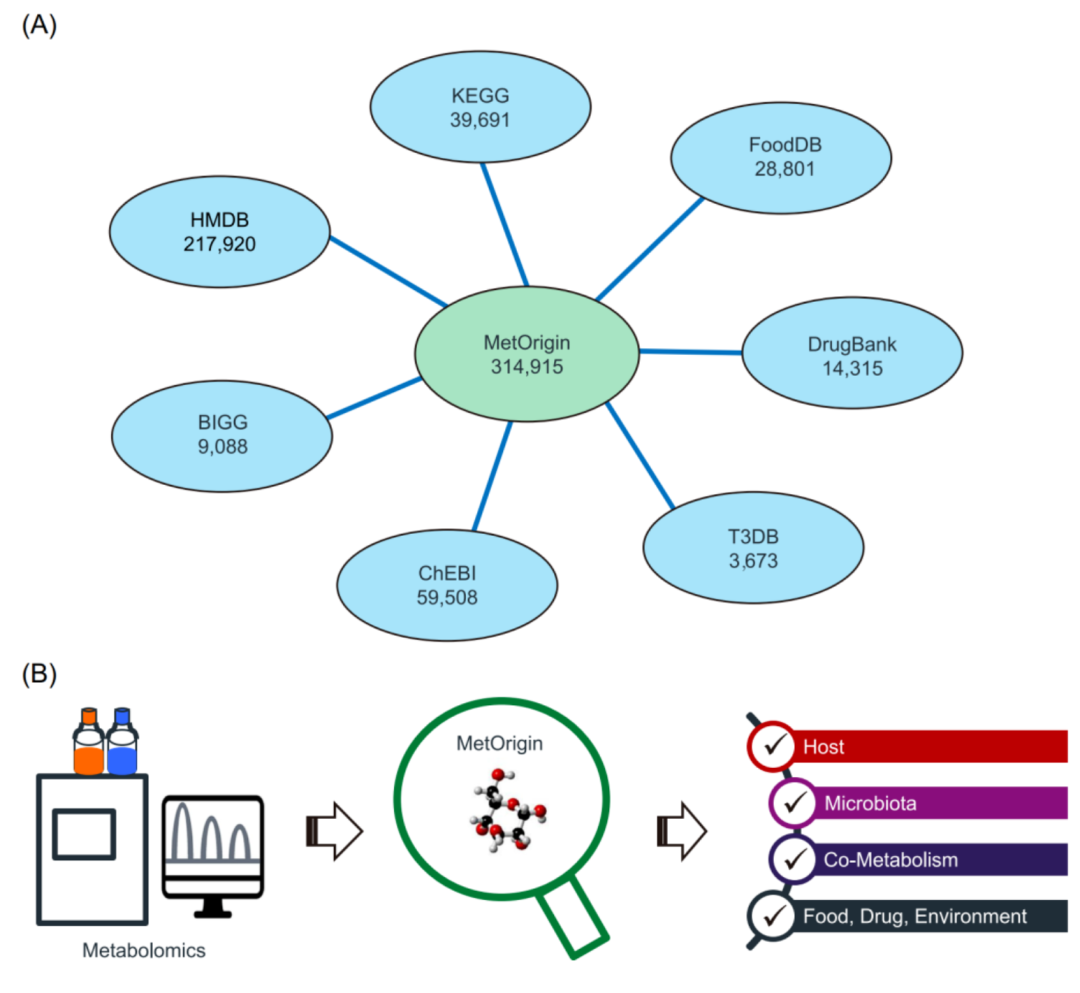
iMeta | 浙大倪艳组MetOrigin实现代谢物溯源和肠道微生物组与代谢组整合分析
第1卷第1期
第1卷第2期
第1卷第3期
第1卷第4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:[email protected]