点击蓝字 关注我们
口腔微生物组研究的取样策略

https://doi.org/10.1002/imt2.23
PROTOCOL
Volume1, Issue2

●2022年5月13日,北京大学口腔医学院陈峰、陈智滨等在iMeta在线发表了题为“The sampling strategy of oral microbiome”的实验方法类(Protocol)文章。
● 该文章介绍了口腔微生物组研究中各部位的取样策略,包括取样、运输、处理和储存。
● 第一作者:卢洪叶
● 通讯作者:陈峰 ([email protected]); 陈智滨([email protected])
摘 要
口腔内存在多个微生境,共同构成口腔微生态系统。口腔内的菌群主要包括唾液、龈上牙菌斑、龈下牙菌斑、种植体周围的黏膜下菌斑、根管内的菌斑和黏膜表面的菌斑。随着技术的进步,人们对微生物群的认识不断提升。因此,口腔微生物研究也亟需一种可靠、可行、实用性高的口腔微生物组取样方法。本文介绍了口腔微生物的取样策略,包括取样、运输、处理和储存。本文所涉及的材料和设备都是临床实践或实验室中常用的。本文所述取样方法的可行性和可靠性已经过多项研究的验证。
关键词:口腔,微生物组,样本采集,唾液,菌斑
亮 点
● 口腔微生物组研究受到广泛关注,因此亟需一种安全可靠、可行性高、实用性强的口腔微生物组取样方法
● 口腔内主要菌群及取样部位包括唾液、龈上菌斑、龈下菌斑、种植体周黏膜下菌斑、感染内根管菌斑、舌背、黏膜表面等
● 本文介绍了口腔微生物组研究的具体取样方法,包括样品的采集、运输、样本处理和储存
视频解读
Bilibili:https://www.bilibili.com/video/BV15T4y1B7f9/
Youtube:https://youtu.be/I8PAerJ-RBg
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
口腔是人体第二大微生物,仅次于肠道。口腔微生物群由细菌、真菌、病毒和原生生物组成,其中细菌是主要组成部分。微生物在个体之间存在差异,而且在不同的临床条件、微环境和其它影响因素下有所不同。它与口腔健康,甚至全身健康紧密相关。多项研究已证实微生物是多种口腔疾病的病因,如牙周炎、龋病、黏膜炎。口腔微生物还与一些全身疾病存在潜在联系,在糖尿病、心血管疾病、癌症、阿尔茨海默病等其它全身疾病的发生发展中发挥着一定的作用。同时,口腔微生物也在一定程度上受到全身因素的影响。
尽管口腔微生物已经被研究了几十年,现在仍然受到持续而广泛的关注。研究技术的进步极大地提高了我们对口腔微生物组成、形态特征、功能和相互作用机制的认识,让我们能够更好地探索口腔微生物群落的特征。例如,高通量测序可以探究微生物群落的整体构成;荧光原位杂交(FISH)可以展现菌斑的空间结构;蛋白质组学和代谢学有助于探究微生物的代谢物;实验室研究技术的进步有助于我们研究微生物的功能和致病性。随着研究技术的发展,牙周炎、种植体周围炎、龋齿、黏膜病等疾病的致病理论也在不断发生着变化。口腔微生物学的发展对口腔微生物群的取样策略提出了更高的要求。
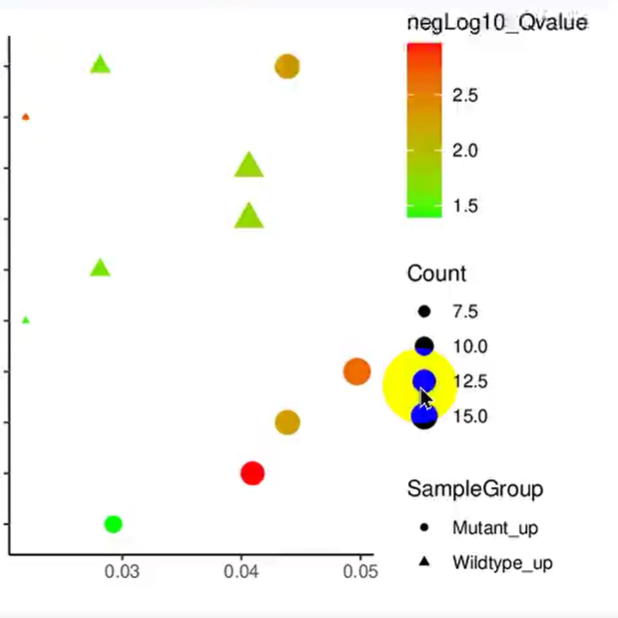
口腔内每个微环境都有不同的微生物群落定植;因此,不同部位的样本可以提供不同的位置信息。唾液的来源多种多样,浸没所有硬组织和软组织的表面,可以用于研究多种口腔疾病以及一些全身疾病。在口腔软硬组织的表面,微生物以生物膜的形式存在,在牙齿表面定植,形成牙菌斑。龈上牙菌斑可用于研究牙齿表面的微生物菌群;龈下菌斑有助于探索牙周病的发病机制;种植体周黏膜下菌斑有助于探索种植体周疾病的发病机制;根管菌斑可提供根管感染或根尖周感染的信息;口腔黏膜上的标本有助于黏膜疾病的研究。
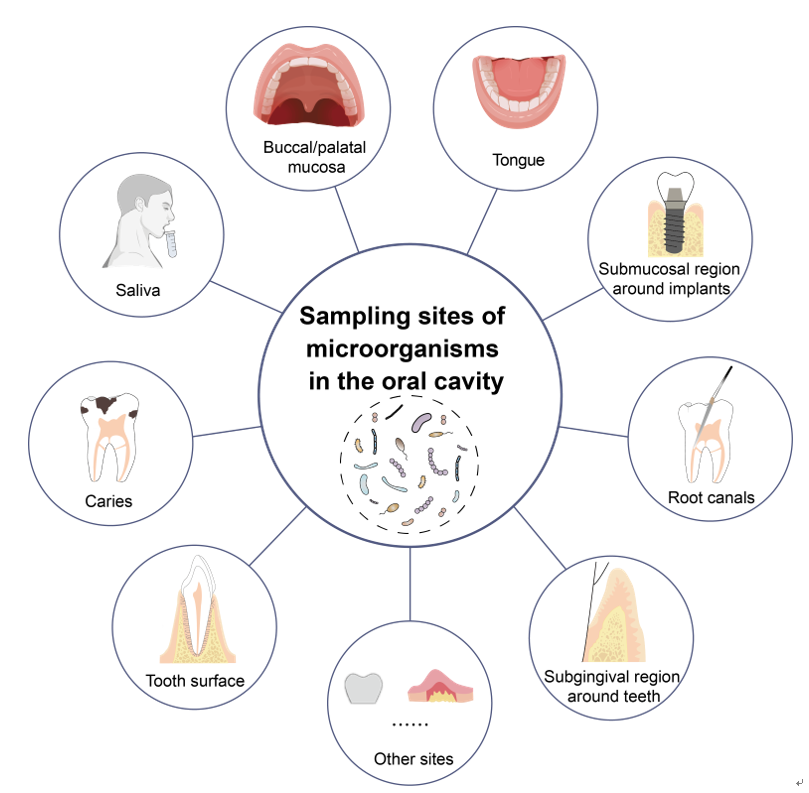
图1. 主要取样位点
1. 唾液样本的采集
唾液是一种富含多种物质的体液,包括水、矿物质、电解质、酶、细胞因子、免疫球蛋白,以及脱落细胞、食物残渣和微生物等。健康的成年人每天产生600-700 mL的唾液,它浸没所有口腔组织的表面,包括牙齿、牙龈、舌头、上颚和黏膜。唾液作为口腔微生物群的“储库”,收集来自多个部位的微生物。反过来,唾液也能够将微生物转移到这些微环境中。唾液是一种非侵入性并容易获得的样本,是一种口腔微生物组研究常用的样本类型。
唾液流量在白天有所波动,饮食和口腔卫生措施对唾液微生物群均有影响。唾液流量在睡觉时减少,在早上醒来后逐渐增加。因此,建议在早上刷牙前或三餐之间采集唾液样本。唾液样本的采集分为两种:非刺激性唾液和刺激性唾液。非刺激性唾液是在生理条件下获得的,而刺激性唾液是在咀嚼刺激或味觉刺激后获得的。刺激性唾液最初用于评估唾液腺的功能。有报道称,刺激性唾液和非刺激性唾液的微生物组成存在差异。考虑到刺激物质可能会对唾液微生物产生影响,一般建议非刺激性唾液用于口腔微生物的研究。
1.1 材料与设备
无菌杯状容器;注射器;刺激物(口香糖、棉球、蜡、酸糖、柠檬酸或刺激视频);冰盒或干冰桶;无菌离心管;离心机;移液器;超低温冰箱。
1.2 唾液采集
收集非刺激性唾液有四种方法:
方法一:让志愿者拿着无菌容器;静静地坐着,低着头,嘴巴微微张开,眼睛微微睁开,头微微向前;避免吞咽,让唾液自然流进容器。
方法二:让志愿者抬起头静坐,避免吞咽;将唾液聚集于口底,然后将其吐入容器中。
方法三:嘱患者坐在牙科椅上,张开嘴;用注射器吸掉积聚在口腔里的唾液。
方法四:将无菌棉花或其他吸水材料放入口中吸取唾液;然后,把唾液挤进容器。
收集1 mL非刺激性唾液通常需要5-10分钟。用吸水材料收集唾液应避免擦拭到黏膜表面的菌斑。
收集刺激性唾液有三种方法:
方法一:让志愿者咀嚼刺激性物质,如石蜡、无味口香糖碱、棉球、橡皮筋等30 s;将积累的唾液吐入容器(咀嚼刺激)。
方法二:将酸糖或4%柠檬酸滴于舌背,等待1分钟;要求志愿者将积聚的唾液吐入容器中(味觉刺激)。
方法三:观看酸性食物的视频或想象一些酸性食物也有助于收集唾液;让志愿者将唾液吐入容器(想象刺激)。
收集1 mL刺激性唾液通常需要1-5分钟。
1.3 样品运输及加工
可将样品放入冰盒或干冰桶中转送至实验室(最好在3小时内)。将收集的唾液分离到1.5 mL无菌离心管中,离心(10000g - 16000g, 4℃,15min)。取出上清液,留沉淀作进一步检测。
1.4 样品存储
最好尽快将样品送去后续检测分析。如不能立即分析,可在-80℃超低温冰箱中保存;也可在-20℃临时保存一个月。要从细菌中获取DNA,需在冷冻之前进行离心并形成细菌团块;如果样品留作后续细菌培养,应加低温保护剂(如80%甘油或10-20%脱脂牛奶)。
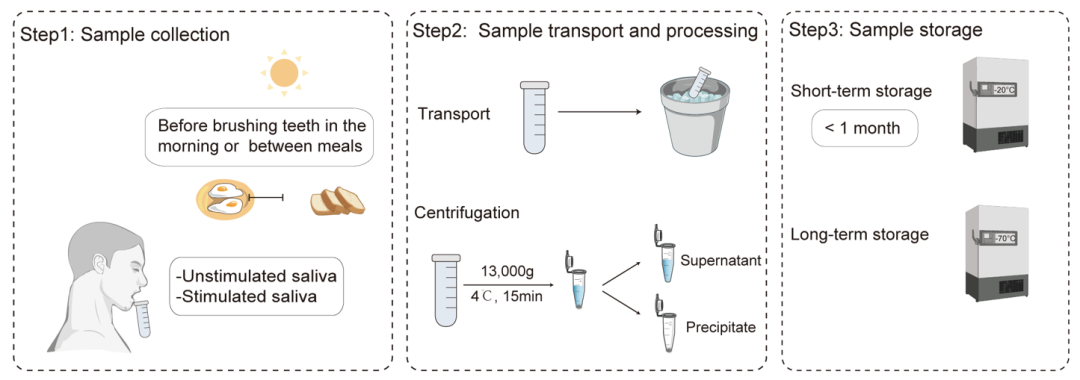
图2. 唾液取样过程
2. 龈上牙菌斑取样方法
细菌在牙齿表面通过获得性膜定植,获得性膜主要由唾液蛋白和糖蛋白组成。龈上牙菌斑是一个以生物膜的形式存在于牙齿上的生态系统,受多种因素的影响,包括食物、咀嚼、肌肉活动、唾液冲洗和口腔卫生措施等。生物膜的形成和产酸微生物的积累是龋病公认的病因。牙菌斑能够通过代谢碳水化合物产生酸,导致龋齿。链球菌已被确定为龋齿的主要病原体,它可以通过产生酸和水溶性葡聚糖来诱发龋齿的。产酸菌的比例和数量是影响龋病活性的核心因素。龈上微生物分析可为口腔健康研究提供依据。
2.1 材料与设备
配有镊子、探针和口镜的口腔检查盘;无菌棉棒或橡皮障;牙面菌斑的取样工具(无菌探针、棉签或刮板);龋洞内菌斑样本的取样工具(无菌探针、刮匙、挖匙、牙线或细钢丝);无菌离心管;缓冲液(RNA保护试剂、TE缓冲液、Tris-HCl、EDTA、生理盐水、PBS或双蒸馏水);冰盒或干冰桶;离心机;移液器;超低温冰箱。
2.2 样本采集
取样过程是在牙科椅上进行的,采用无菌设备。在采集样本前,用纯净水漱口,清除口腔内残留的食物残渣。
牙齿表面菌斑的采集:请志愿者张开口,取样前用无菌棉卷或橡皮障将取样部位与唾液隔离。使用无菌探针、棉签或刮板从目标牙齿表面刮取菌斑样本。然后将样品转移到0.6 mL无菌离心管中。也可以使用无菌小刷子或棉签采集牙菌斑,然后在准备好的缓冲液中荡洗约1分钟,将牙菌斑洗脱。
龋洞内菌斑的采集:龋洞内收集牙菌斑的工具取决于龋洞的位置和外形,通常使用无菌探针和刮匙收集牙菌斑的咬合面和轴面;近端表面可使用无菌探针、牙线或细钢丝;可使用无菌刮匙采集根面龋样本;无菌挖匙可用于柔软潮湿的窝洞。取样后,在准备好的缓冲液中洗脱菌斑(洗脱约1分钟)。
根据研究目的,收集菌斑的缓冲液可以是RNA保护试剂、TE缓冲液、10 mM Tris-HCl、1 mM EDTA、磷酸盐缓冲盐水(PBS)、生理盐水和双蒸馏水,这些缓冲液都能够实现后续微生物组的保存和检测。RNA保护试剂、TE缓冲液、Tris-HCl和EDTA均能保护RNA和DNA不被裂解。PBS缓冲液(pH=7.4)处理有利于上清液中蛋白、细胞因子的后续分析;用双蒸馏水处理后允许后续小分子代谢物的检测。此外,多个指数牙的混合样本可以用于研究患者水平的微生物组;具有相同临床条件的多个部位的混合样本可用于研究相应的微生物组特征。
2.3 样品运输及加工
采集的样本可以用冰盒或干冰桶运输到实验室。将采集的样品离心(10000g - 16000g, 4℃,15min),得到沉淀,用于进一步检测。
2.4 样品存储
尽快将样品送去后续检测分析。如不能立即分析,可在-80℃超低温冰箱中保存;也可在-20℃临时保存一个月。要从细菌中获取DNA,需在冷冻之前进行离心并形成细菌团块;如果样品留作后续细菌培养,应加低温保护剂(如80%甘油或10-20%脱脂牛奶)。
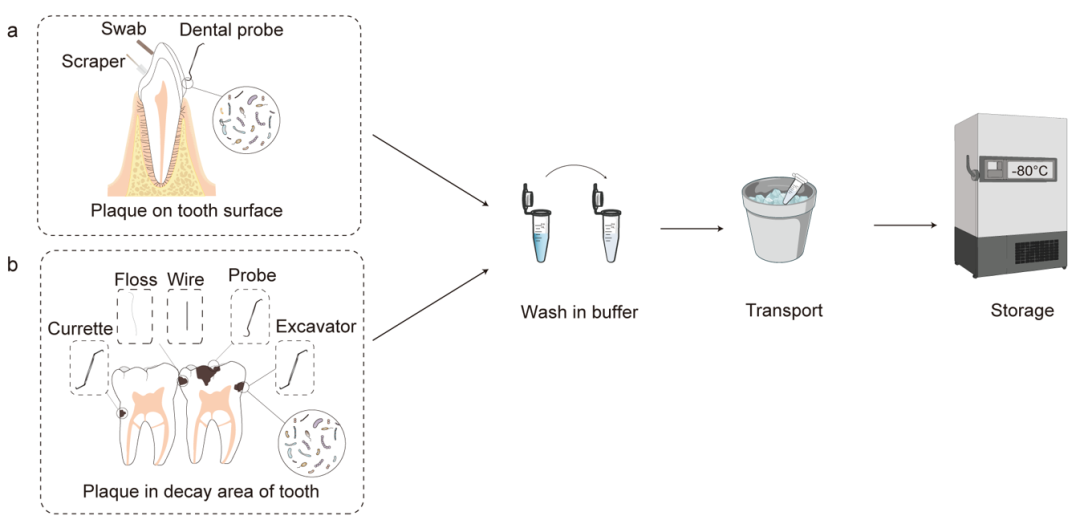
图3. 龈上牙菌斑取样过程
a.牙齿表面的龈上牙菌斑。b.龋坏组织中的牙菌斑
3. 牙周龈下菌斑和种植体周黏膜下菌斑的取样方法
龈下牙菌斑已被广泛认为是牙周炎发生的使动因素,菌斑的积累也被认为是种植体周病的病因。基于相似的解剖结构和免疫学特征,牙周和种植体周病的致病机制相似。牙周/种植体周围袋壁的炎症组织可能是全身感染的一个窗口。因此,对龈下和黏膜下微生物群的研究有助于评价牙周病和种植体周病的关键致病因素,还可以促进我们对口腔感染和全身状况之间关系的了解。
3.1 材料与设备
配有镊子、探针和口镜的口腔检查盘;无菌棉卷;无菌刮匙;纸条/纸尖;0.6 mL、1.5 mL无菌离心管;缓冲液(RNA保护试剂、TE缓冲液、Tris-HCl、EDTA、生理盐水、PBS或双蒸馏水);冰盒或干冰桶;酒精灯;振荡仪;离心机;移液器;超低温冰箱。
3.2 样本采集
根据研究设计,可在位点水平、牙/种植体水平和患者水平采集样本。位点特异性标本可提供局部组织的健康信息。牙齿/种植体水平的研究一般需要取样1 - 6个位点,取样点通常选择在目标牙的颊侧近中和颊侧远中,这样可以尽量避免唾液污染。对于龈沟较浅的牙齿或种植体,采集多个位点的样本有助于获得足够数量的微生物。患者水平的研究需要集中几颗牙齿或种植体的样本。Ramfjord指数牙被认为是评价牙周整体状况的代表性牙位,Ramfjord指数牙包括16、21、24、36、41、44。如果指数牙已经脱落,可以采集同一区域相邻的牙齿。
样本采集前,请志愿者漱口,以清除口中的食物残渣。用探针或刮板或小棉球刮除龈上牙表面的牙石、食物残渣、菌斑和软垢后,用无菌棉在取样点周围隔离唾液。
牙周龈下菌斑或种植体周黏膜下菌斑取样一般在牙科治疗椅上,使用无菌取样工具。采集龈下菌斑和种植体周围黏膜下菌斑的常用方法有刮匙法(图4a)和吸附法(纸条法,图4b),两者都是比较可靠的。刮匙法主要是收集附着在牙齿或种植体表面的附着菌斑;而吸附法在收集牙周或种植体周袋内非附着性菌斑更具优势。
刮匙法(菌斑法):用无菌牙周刮匙刮取牙周袋内的龈下菌斑或种植体周围的黏膜下菌斑,置于0.6 mL无菌离心管中,在冰盒或干冰桶中运输。
吸附法(龈沟液法):龈下/黏膜下菌斑取样时,推荐使用2mm*10mm滤纸条(Whatman,英国)或02锥度 35#吸潮纸尖(GAPADENT,中国),尖端切除0.5-1 cm。滤纸条应使用无菌工具处理,取样前进行高压蒸汽灭菌并干燥。持吸收纸尖或滤纸条,沿牙齿表面插入牙周袋,遇阻力坚持30 s后,放入0.6 mL无菌离心管中,接着放入冰盒或干冰桶中运输。应将纸条或纸尖置于沟或袋的底部,以获得疾病进展前沿的菌斑。对于袖口较紧的健康种植体周围组织,刮匙很难在不损伤黏膜的情况下插入。在这种情况下,最好使用吸潮纸尖的吸附法,沿着牙龈或黏膜边缘小心地将吸潮纸尖插入沟或袋内。
3.3 样品处理
采集的样本可以用冰盒或干冰桶运输到实验室。
刮匙法:将采集的样品离心(10000g - 16000g, 4℃,15min),得到沉淀物,作进一步检测。
吸附法:用滤纸条或滤纸尖采集的样品需要用套管法处理。详细过程如下:100μL缓冲溶液添加到0.6 mL离心管与无菌滤纸条或吸水纸尖样品中,在4℃振动30 - 60分钟,将0.6 mL离心管反过来,用烧红的针尖在中心的底部扎一个小孔(小于滤纸条或吸水纸尖的直径)。将试管放入1.5 mL无菌试管中,对称离心(10000g - 16000g, 4℃,15min)。将上清液轻轻吸走,放入另一离心管中保留,沉淀即可作为菌斑样品。样品需要在加工前冷冻保存。
3.4 样品存储
尽快将样品送去后续检测分析。如不能立即分析,可在-80℃超低温冰箱中保存;也可在-20℃临时保存一个月。要从细菌中获取DNA,需在冷冻之前进行离心并形成细菌团块;如果样品留作后续细菌培养,应加低温保护剂(如80%甘油或10-20%脱脂牛奶)。
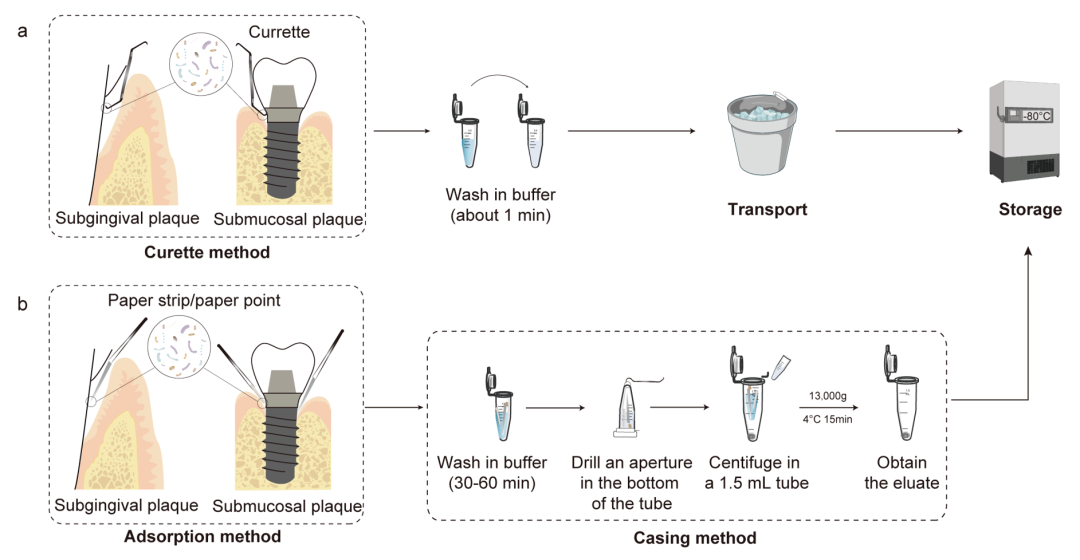
图4. 牙周龈下菌斑和种植体周黏膜下菌斑的取样过程
a.刮匙法 b.吸附法
4. 根管内菌斑取样方法
细菌在根管内的定植可导致牙髓炎、根尖周炎,甚至骨髓炎。根管中微生物的状况决定了炎症程度、临床症状及后续治疗效果。因此,清除感染根管内的细菌,防止牙根管再感染是根管治疗保存牙齿的关键。对于长期和难治性感染或有全身感染扩散风险的病例,建议根管取样进行微生物诊断。
4.1 材料与设备
配有镊子、探针和口镜的口腔检查盘;无菌棉棒或橡皮障;无菌刮匙;吸潮纸尖;0.6 mL、1.5 mL无菌离心管;缓冲液(RNA保护试剂、TE缓冲液、Tris-HCl、EDTA、生理盐水、PBS或双蒸馏水);冰盒或干冰桶;酒精灯;离心机;移液器;超低温冰箱。
4.2 样本采集
感染根管内的菌斑标本通常采用无菌纸尖吸附取样法。如果有大量渗出物,也可以用冲洗器吸取。以下操作是在牙科治疗椅上使用无菌设备进行的。取样前,先清除牙冠上的食物残渣、牙石、牙菌斑及软垢,以免污染牙齿;用根管预备器切开根管壁,开放入路。此外,样品的采集需要创造进入髓腔和根管的路径(避免过度冲洗造成菌斑破坏)。
使用无菌棉隔离取样区域。将无菌吸潮纸尖(根据根管的锥度和厚度选择吸潮纸尖)插入根管,停留30 s。取出后放入0.6 mL无菌离心管中,放入冰盒或干冰桶中运输。纸条的尖端是湿的,这可能表明样品采集是成功的。如果根管干燥,纸尖难以吸收牙菌斑,可以注射一些无菌溶液(如生理盐水或双蒸馏水),然后用注射器或纸尖提取根管内的液体。
4.3 样品处理
采集的样本可以用冰盒或干冰桶运输到实验室。
用纸条或滤纸尖采集的样品需要用套管法处理。详细过程如下:100μL缓冲溶液添加到0.6 mL离心管与无菌滤纸条或吸水纸尖样品中,在4℃振动30 - 60分钟,将0.6 mL离心管反过来,用烧红的针尖在中心的底部扎一个小孔(小于滤纸条或吸水纸尖的直径)。将试管放入1.5 mL无菌试管中,对称离心(10000g - 16000g, 4℃,15min)。将上清液轻轻吸走,放入另一离心管中保留,沉淀即可作为菌斑样品。样品需要在加工前冷冻保存。
4.4 样品存储
尽快将样品送去后续检测分析。如不能立即分析,可在-80℃超低温冰箱中保存;也可在-20℃临时保存一个月。要从细菌中获取DNA,需在冷冻之前进行离心并形成细菌团块;如果样品留作后续细菌培养,应加低温保护剂(如80%甘油或10-20%脱脂牛奶)。
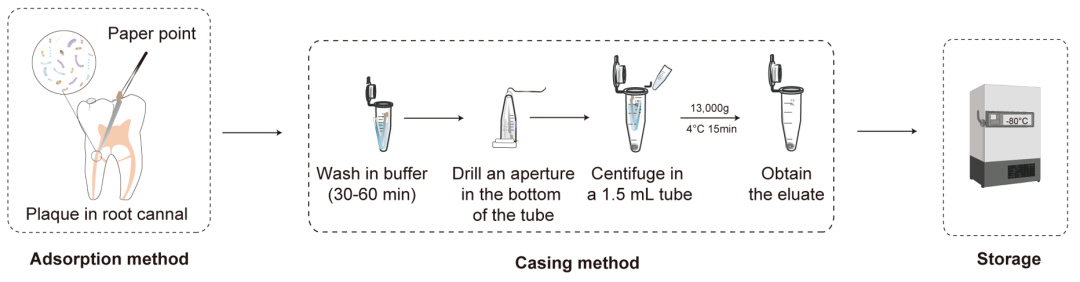
图5. 根管内菌斑的取样过程
5. 口腔黏膜表面菌斑的取样方法
口腔黏膜是口腔内的复层鳞状上皮,主要分为咀嚼黏膜、被覆黏膜和特殊黏膜。健康的上皮细胞由于肌肉运动和唾液冲刷只在其上形成薄层状生物膜,而溃疡或病变的黏膜上通常有许多微生物聚集并渗入组织。舌背上皮表面有丰富的乳头,为微生物的定植和繁殖提供了良好的微环境。口腔黏膜除舌背外,还包括口底黏膜、舌外侧和舌腹、颊黏膜、硬腭、软腭、牙龈和扁桃体等软组织表面。黏膜上的微生物与黏膜的健康和疾病密切相关。口臭、疱疹龈口炎、手足口病和口腔念珠菌病是由病原微生物引起的,包括细菌、病毒和真菌。黏膜微生物组分析还可以辅助一些有口腔表现的全身感染的诊断和评价,如口腔结核、梅毒等。
5.1 材料与设备
配有镊子、探针和口镜的口腔检查盘;无菌棉签、毛刷或棉条;0.6 mL、1.5 mL无菌离心管;缓冲液(RNA保护试剂、TE缓冲液、Tris-HCl、EDTA、生理盐水、PBS或双蒸馏水);冰盒或干冰桶;离心机;移液器;超低温冰箱。
5.2 样品采集和运输
口腔黏膜的取样部位主要包括舌背、颊黏膜和上颚。在取样前,应先用纯净水漱口,清除口腔内的食物残渣。
舌背:请志愿者略微张开自己的嘴和扩展他们的舌头,用无菌刷子刷从一边到另一边的覆瓦状的舌头,切断与菌斑的刷头,并置于无菌管中。也可使用无菌刮板和棉签收集舌背上的菌斑。
其他口腔黏膜(被覆黏膜、咀嚼黏膜):用无菌棒或棉签刮取黏膜表面菌斑,放入无菌管中,用缓冲液在管中反复荡洗。将样品置于冰盒或干冰桶内运输。
5.3 样品处理
加入新准备的缓冲溶液。将小刷子在缓冲液中荡洗,低温(10000 g- 16000g,4℃,15 min)离心,轻轻吸收弃上清,得到沉淀作为菌斑样品。
5.4 样品存储
尽快将样品送去后续检测分析。如不能立即分析,可在-80℃超低温冰箱中保存;也可在-20℃临时保存一个月。要从细菌中获取DNA,需在冷冻之前进行离心并形成细菌团块;如果样品留作后续细菌培养,应加低温保护剂(如80%甘油或10-20%脱脂牛奶)。
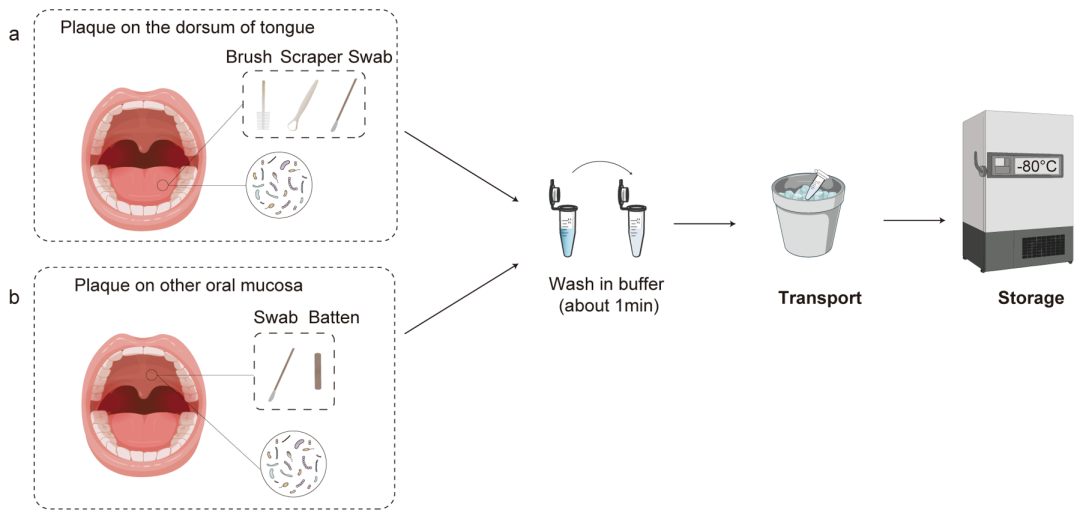
图6. 口腔黏膜表面菌斑的取样过程。
a.用无菌刷、刮板或棉签对舌背菌斑进行取样。b.用无菌棒或棉签从其它黏膜表面取样
6. 其他位点的取样方法
口腔内有潴留、积液和脓肿,可能是感染的结果。这些部位可根据数量和位置使用无菌注射器或无菌纸条进行取样,有时可能需要手术来创建取样入路。
总 结
取样工作可由牙医、牙科保健师或训练过的研究人员进行。样本采集最重要的是避免伤害志愿者。在收集牙周龈下菌斑和种植体周黏膜下菌斑时,牙龈特别容易受伤。另一个关键点是避免对取样部位邻近菌群的污染。收集牙周龈下菌斑、种植体周黏膜下菌斑、根管内菌斑时,可能会因牙龈紧窄被龈上牙菌斑污染;唾液也很容易被黏膜表面的菌斑污染。
在口腔内常规定植的微生物可以作为个体的特征性指纹,可以在一定程度上反映个体特征。另一方面,口腔是一个复杂的、不断变化的环境,同时也受到各种全身因素和外部因素的影响。因此,只有实时取样分析才能了解口腔微生物群落准确的动态信息。微生物组的特征受多种因素的影响,如年龄、性别、昼夜节律、饮食、吸烟、生理状况、口腔卫生措施和服用药物等。因此,研究者应密切关注影响因素,根据研究目的选择合适的取样方式。
作者简介

卢洪叶(第一作者)
● 博士,临床博士后
●主要研究方向:牙周微生物菌群与全身疾病;种植体周微生物与宿主免疫;口腔数字化美学。以第一作者在Journal of Clinical Periodontology、Journal of Dentistry等口腔Top期刊发表多篇SCI论文, 获得中国博士后特别资助一项

陈智滨(通讯作者)
● 主任技师,主治医师,医学学士
● 1985年-1990年担任首都医科大学附属宣武医院5年制本科生实验诊断学教学工作、同时承担北京市临检质控中心质控工作。1991年至今到本院牙周科工作,从事牙周病临床、教学和科研工作,2012-2013年美国马凯特牙医学院访问学者工作。主要研究内容包括1、牙周病微生态与临床诊断关系;2、牙周病伴有慢病患者的实验诊断学研究;3、牙周病致病微生物与免疫学;4、自体全血提取有效成分临床应用研究(在研);负责牙周科实验室建设及管理和研究生实验技术指导及教学工作;先后参加国家级、省部级、十一五、博士点、863、985、市和院级各种科研课题近50余项;国内外发表论文100多篇;第一申请人发明专利2项;获得国家级、省部级等多项科技成果奖。第一申请人获得发明专利2项,专利转化产品完成已经投入临床应用。科技成果奖证书3项

陈峰(通讯作者)
● 北京大学口腔医学院,副研究员,博士生导师
● 2006年毕业于清华大学生命科学学院并获得理学博士学位,2007-2010年在美国加州大学洛杉矶分校牙医学院从事博士后研究,2011年至今在北京大学口腔医学院工作,负责中心实验室微生物平台。目前担任中华口腔医学会口腔生物医学专委会委员、口腔科研管理专委会青年委员及北京生物工程学会人体微生态分会常委。作为第一/通信作者已发表学术论文逾百篇,包括J Dent Res、Adv Sci、STTT等国内外权威杂志(2018年发表于Protein Cell的“Oral microbiomes: more and more importance in oral cavity and whole body为ESI高被引论文),并受邀作为J Dent Res、Ebiomedicine、IJOS等期刊审稿人,Front Pharmacol杂志客座编辑,iMeta期刊编委。主持国家自然科学基金项目3项,省部级科研基金项目2项。课题组主要研究方向为口腔微生态与疾病研究(微生物宏基因组学与唾液蛋白/多肽组学),以及口腔遗传病(唇腭裂)机制研究。
更多推荐
(▼ 点击跳转)
iMeta封面 | 宏蛋白质组学分析一站式工具集iMetaLab Suite(加拿大渥太华大学Figeys组)
iMeta | 深圳先进院马迎飞组开发基于神经网络分析肠道菌群的方法
iMeta | 南医大陈连民等综述从基因组功能角度揭示肠菌对复杂疾病的潜在影响
iMeta | 北大陈峰组综述口腔微生物组的标准化研究:从技术驱动到假说驱动
iMeta | 电子科大林昊组开发蛋白质赖氨酸乳酸化位点预测工具DeepKla
iMeta | 南昌大学丁霞等-水产养殖系统对中华鳖微生物组和肠道代谢组的影响
iMeta | 华中科大宁康组综述用于蛋白质结构预测的宏基因组定量分析
iMeta | 中科院李小方等膳食甘草促进小鼠镉解毒并调节肠道菌群代谢
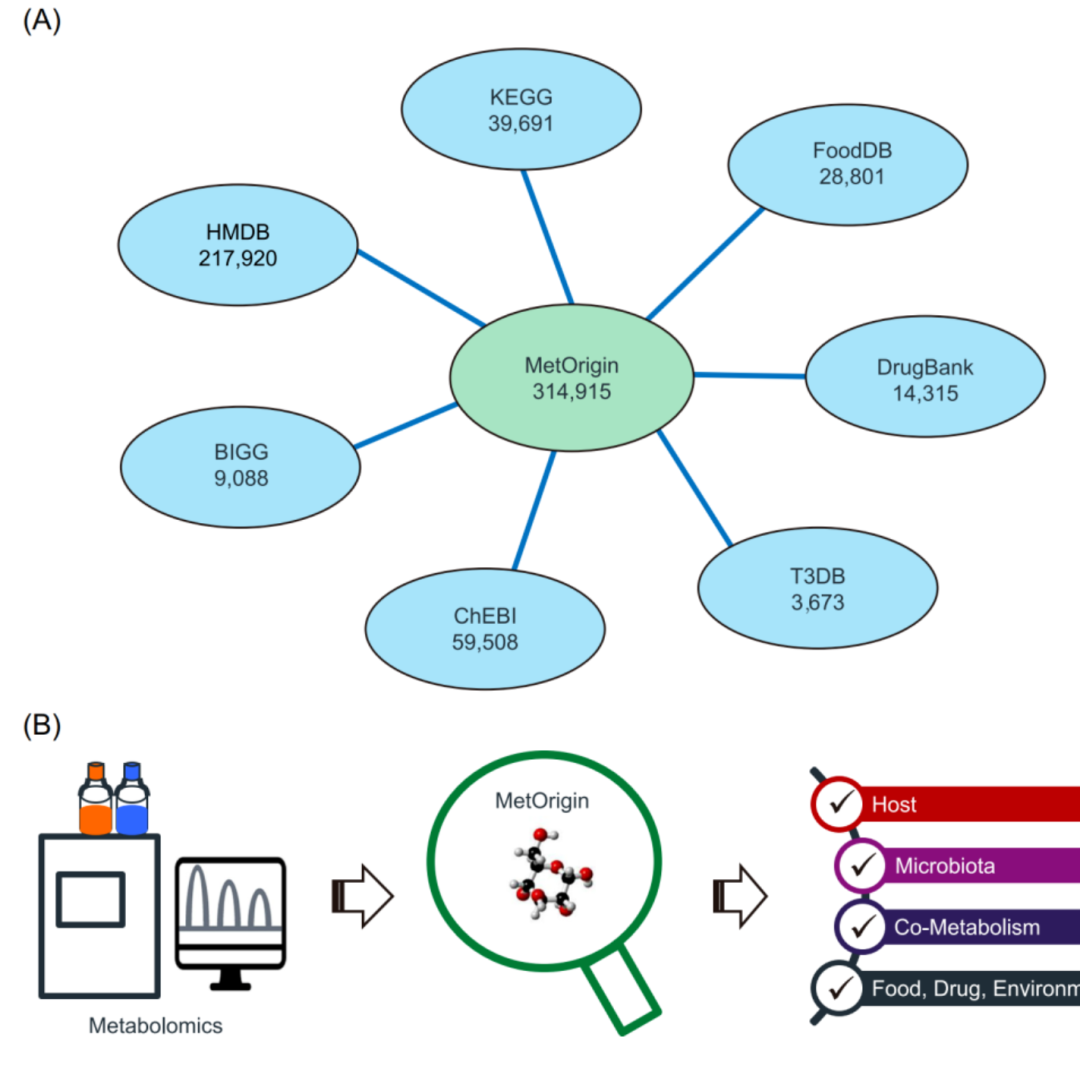
iMeta | 浙大倪艳组MetOrigin实现代谢物溯源和肠道微生物组与代谢组整合分析
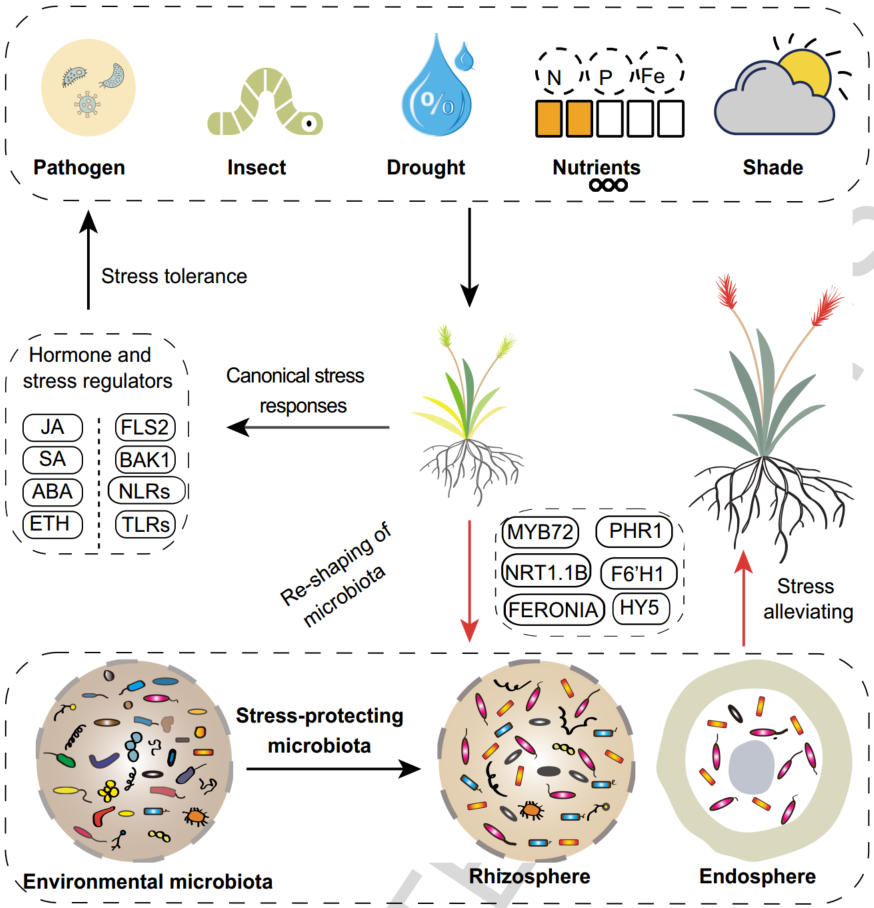
iMeta | 南科大宋毅组综述逆境胁迫下植物向微生物组求救的遗传基础(附招聘)
期刊简介

“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:[email protected]
微信公众号
iMeta
责任编辑
微微