Auka热液喷口区的微生物群落揭示了喷口区的生物地理学和嗜热性的进化历史
Microbial community of recently discovered Auka vent field sheds light on vent biogeography and evolutionary history of thermophily
Article
The ISME Journal, [IF 10.3]
DOI:10.1038/s41396-022-01222-x
原文链接:https://www.nature.com/articles/s41396-022-01222-x
第一作者:Daan R. Speth
通讯作者:Daan R. Speth 和Victoria J. Orphan
主要单位:Division of Biology and Biological Engineering, California Institute of Technology, Pasadena, CA, USA
翻译:周之超@UW-Madison
摘要
Abstract
热液喷口一直是我们了解生命极限以及嗜热生物的代谢和系统发育多样性的关键。在这里,我们利用环境宏基因组学,结合物理化学数据和16S rRNA扩增子的分析,来描述最近在加利福尼亚湾发现的Auka喷口(太平洋已知最深的热液喷口区)的沉积物微生物的多样性、温度选择和生物地理分布。我们恢复了325个宏基因组组装的基因组(MAGs),代表54个门类,超过目前已知门类多样性的1/3,表明Auka热液沉积物中的微生物群落是高度多样化的。对整个喷口区227个沉积物样品的大规模16S rRNA扩增子筛选表明,MAGs在很大程度上代表了微生物群落。对Desulfobacterota(Tharpobacteria)内一个特定的、深度分支的支系的代谢重建表明,这些生物体利用与羟胺氧化还原酶有关的新型八氢细胞色素-c蛋白来代谢硫。将AukaMAGs的平均核苷酸相似度与西北400公里外的Guaymas盆地喷口区的MAGs进行群体比较,发现喷口区之间有明显的20%的物种水平重叠,表明有长距离的物种转移和沉积物移殖。最近开发的用于预测Auka和Guaymas火山口的最佳生长温度的模型的一个改编版本表明,这些未培养的微生物中有几个可以在超过目前已知的生命上限的温度下生长。将这一分析扩展到参考数据显示,嗜热性是一种在细菌和古细菌中经常进化的特性。综合来看,我们的结果表明,Auka喷口地区为我们了解热液喷口微生物学提供了新的视角。
引言
Introduction
热液喷口的微生物群落长期以来一直受到关注,因为它们对深海的局部生产力和营养循环有影响,是地表下生物圈的表面表现,也是冰卫星上海洋生物的潜在类似物。这些化合群落与居住在周围海底的群落有很大的不同,但对不同热液区之间的变化还不是很了解。根据宿主岩性,热液区可分为三类:basalt-hosted(玄武岩基)、ultramafic(超镁铁质)和sediment-hosted(沉积物基)。大多数研究良好的高温喷口都是玄武岩基,热液直接从裂缝排入上层海水。相比之下,沉积物基的热液喷口,如在Guaymas盆地发现的那些,其特点是过热流体与上覆沉积物的相互作用。这种相互作用通过在平流到海底的过程中加入热降解的有机化合物,进一步改变了流体的组成,导致沉积物中的温度梯度陡峭,并导致近海底表面产油作用。
这种额外的复杂性使沉积物基的喷口成为有吸引力的微生物生态学研究地点。事实上,Guaymas盆地已被证明是发现嗜热微生物新型代谢能力的一个特别丰富的来源。这方面的例子包括Desulfofervidus sp.细菌和ANME-1古菌的联合体所介导的嗜热厌氧甲烷氧化加上对硫酸盐的还原,硫酸盐还原菌Desulfosarcina BuS5的厌氧丁烷降解,以及Synthrophoarchaeum sp.和Desulfofervidus sp.细菌联合体的厌氧丁烷氧化。此外,一些最极端的嗜热菌,Methanopyrus kandleri和Pyrodictium abyssi,最大的测量生长温度分别为122℃和110℃,已经从Guaymas盆地的沉积物和烟囱中分离出来。Guaymas盆地在发现微生物过程中的巨大作用,使得Auka喷口--沿加利福尼亚湾同一断层的第二个沉积物基热液喷口系统的最近发现特别令人激动,因为它为沉积物基的热液喷口系统的比较分析提供了独特机会。
Auka位于南Pescadero盆地>3650米的水深盆地,该盆地是加利福尼亚湾南端的一个拉裂盆地,位于Guaymas盆地东南400公里处。两个地点的热液成分相似。流体呈微酸性(pH值为6),Auka和Guaymas的甲烷(81/16 mmol kg-1)、硫化氢(10.8/6 mmol kg-1)和二氧化碳(49.2/43 mmol kg-1)的浓度分别较高,而氢气浓度相对较低(Auka为2 mmol kg-1)。在这两个地点,在烟囱口测得的流体温度都接近300℃。由于这些高温,在这两个地点通过沉积物平流的流体含有热源性碳氢化合物,源于沉积物有机物的成分。
虽然这两个地方有惊人的相似之处,但也有明显的区别。在3650米处,Auka是太平洋中已知最深的热液喷口系统,是Guaymas盆地的两倍多。较厚的沉积物覆盖(700-1000米),导致热液碳氢化合物的负荷比在Pescadero盆地观察到的要高,那里的沉积物厚度估计不到50米,直接与热液丘毗邻。这两个地点之间的重叠和对比条件的结合,使得它们成为比较分析其微生物群落的首要目标,以阐明在任何一个地点形成微生物种群的因素。
为了描述Auka喷口的沉积物微生物群落的特征,我们分析了从宏基因组测序和基于16S rRNA基因的多样性调查中回收的325个MAGs。然后比较了Auka MAGs和最近从Guaymas盆地沉积物中报告的MAGs的多样性和基因组相似性,为共享的微生物物种和喷口微生物地理学模式提供了重要的见解。我们专注于Auka和Guaymas之间共享的新分支之一,即Desulfobacterota的一个深分支,名为Tharpobacteria,我们对这个与喷口相关的新分支中MAG的代谢潜力进行了详细分析。最后,通过调整基于基因组的最佳生长温度预测模型,我们确定了这些不同系的嗜中温-嗜高温的分布,探索了温度在塑造加利福尼亚湾热液喷口沉积物中的微生物群落中所发挥的作用,以及更广泛地探索了整个生命树的嗜高温进化模式。
结果
Result
Auka喷口区位于南Pescadero盆地的西部边缘,占地约200×600米(图1)。有五个突出的剧烈液体喷发点,被称为P-喷口、C-喷口、Z-喷口、Diane喷口和Matterhorn喷口,每个喷口都有突出的方解石烟囱(图1)。在这些喷口之间有广泛的碳酸盐平台,上面点缀着厘米级的热液排放点,支持局部的化学合成的Oasisia管虫群。这些热液特征是沉积物基的,直接围绕烟囱和碳酸盐平台的沉积物厚度估计小于50米。在整个喷口区,但主要是在Diane的喷口附近和Z-喷口的南部,覆盖在沉积物表面的分散的微生物垫表明通过沉积物进行广泛的平流式热液排放(图1)。微生物垫表现出一系列的颜色:粉红色、灰色/白色、黄色,并含有局部明亮的白点,围绕着闪闪发光的热液流动。30厘米深处的沉积物温度相对于底部海水升高了2.4°C,范围从10°C到177°C,在黄色的微生物垫下面和与可见热液排放有关的亮白区下面测得的温度最高。在Z-喷口南部的微生物垫层内进行沉积物取心时,观察到油滴的释放,这与沉积物内的近海底地表石油生产相一致。

图1采样区概览和Auka喷口区的印象。
A) Auka喷口区的测深图,用名称标注了最突出的集中热液喷发地点。本研究中分析的push core的采样位置被标出,用于宏基因组测序的岩心以橙色标出。B)Diane's 喷口,一个烟囱,清晰可见独特的透明热液排放。C) 马特峰Matterhorn的顶部,一个10米高的独立烟囱,中央孔口周围完全被Oasisia sp.管虫覆盖。烟囱两侧可见微生物垫和浅层法兰结构,表明液体通过烟囱壁扩散排放。D) 碳酸盐平台上覆盖着白色和灰色的微生物垫,有Oasisia sp.管虫(∼20厘米高)聚集在热液排放的局部地点。这是A组中显示的未标记的高土丘的一个代表性例子。E)被微生物垫层覆盖的沉积物(在Diane's 喷口),其颜色和纹理的异质性表明流体在沉积物中扩散的厘米级空间异质性。A组中的push core对应于有普遍的微生物垫的区域。
为了描述Auka喷口的微生物群落的特征,我们对从两个成对的岩芯(DR750-PC67和DR750-PC80)的沉积物进行了鸟枪法宏基因组测序,这两个岩芯收集于距离主Z喷口烟囱约50米处(图1)。这些岩心是在被斑驳的黄色微生物垫层覆盖的沉积物中采集的,距离可见的热液排放和沉积物上的相关亮白点5厘米。DR750-PC80插入时最靠近流体排放口,DR750-PC67直接相邻(相距<2厘米),在远离白点的一条直线上。每个岩芯被切成两个7厘米的地层(0-7厘米和7-14厘米),从而得到四个样本。为了评估附着在沉积物中或形成较大聚集物的微生物群落是否存在差异,对每个地层的一个子样本的<10微米的滤液进行了DNA提取处理;这样将宏基因组样品的总数增加到8个。
经过测序、组装和分类,我们检索到331个宏基因组组装的基因组(MAGs),估计完整性超过50%。回收的MAGs高度多样化,包括212个细菌和119个古细菌,根据基因组分类数据库(GTDB)的分配,代表54个不同的门类(图2)。据估计,这些MAG中的105个完整度大于90%,污染度小于5%,111个MAG含有(片段)16S rRNA基因,可以与来自Auka的更广泛的16S rRNA扩增子调查数据直接比较。
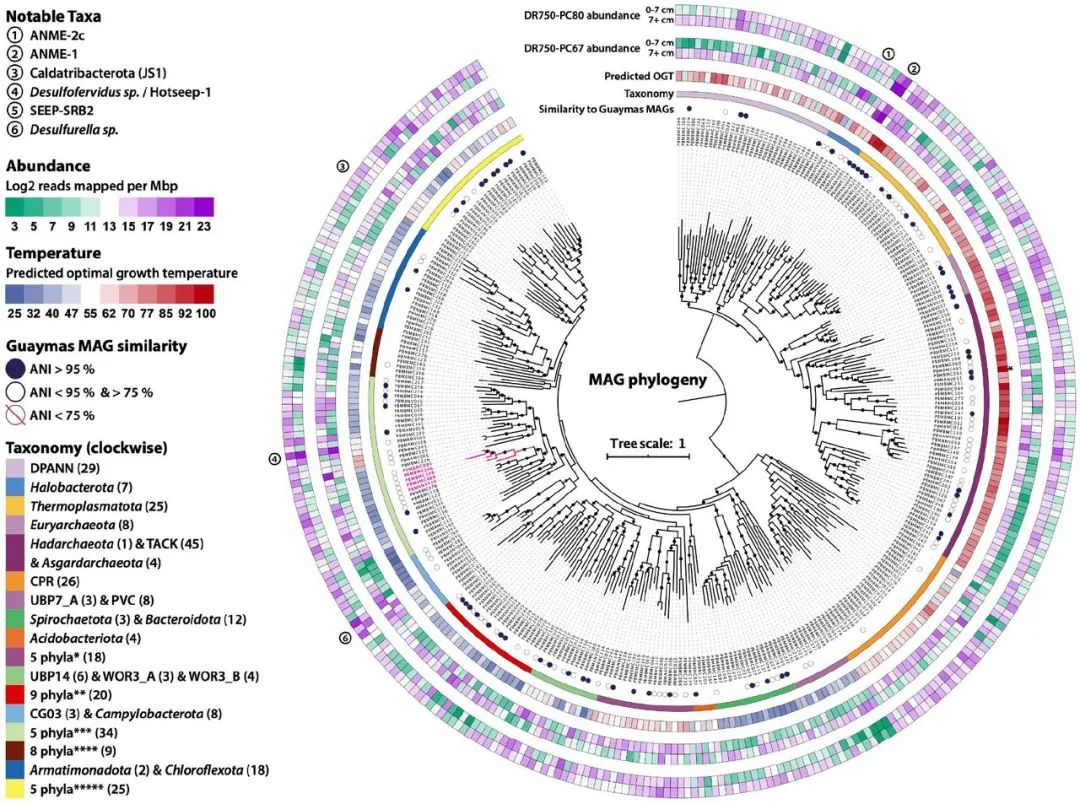
图2 325个AukaMAGs的联合标记基因的系统发育情况。根据25个联合标记基因,从Auka喷口沉积物中找到的325个MAGs的系统发生。比例尺表示每个位点有一个替换。从内到外,系统发育周围的同心圆表示:MAG ID、与以前从Guaymas盆地回收的MAG的平均核苷酸一致性(ANI)、门水平分类、MAG预测的最佳生长温度(OGT)、DR750-PC67岩心表面(0-7cm)和深处(7+cm)的MAG丰度,以及DR750-PC80岩心表面(0-7cm)和深处(7+cm)的MAG丰度。括号中的数字表示数据集中属于该系的MAG数量(图中显示了所有MAG)。Tharpobacteria分支(见正文)用粉红色突出。PBMBMC_261的预测OGT(111℃)不在刻度范围内,用星号表示。与分类学图例中的缩略组相对应的门。*1 UBP7 (1), Ratteibacteria (2), Omnitrophota (6), Calescibacterota (2), Aerophobota (7); **Fermentibacterota (1), Krumholzibacteriota (1), Cloacimonadota (4), Latescibacterota (3), Zixibacteria (2) KSB1 (1) SM23-31 (1), Calditrichota (1), Marinisomatota (6); ***Proteobacteria (2), Myxococcota (1), Desulfuromonadota (3), Desulfobacterota_A (5), Desulfobacterota (23); ****UBP3 (1), Sumerlaeota (1), RBG-13-66-14 (1), Poribacteria (1), Hydrogenedentota (1), Eremiobacterota (1), Firmicutes (1), Firmicutes_A (2); *****Caldatribacteriota (2), Synergistota (3), Caldisericota (3), Bipolaricaulota (6), Thermotogota (11).
15种MAG在<10μm的过滤部分中被损耗了2倍以上。这一部分中耗损最多的MAG是一个主要的ANME-2c古菌,这与这个甲烷营养分支的成员经常与合成硫酸盐还原菌(SRB)一起形成>10μm的多细胞联合体相一致。值得注意的是,ANME-2c的假定硫酸盐还原伙伴(如Desulfobacterota SEEP-SRB2),在过滤部分也被耗尽(1.88倍)。另一个在过滤部分被耗尽的支系是最初从甲烷冷渗漏中描述的异养细菌Izimaplasma。虽然该支系的厌氧富集由自由生活的生物体组成,但它们在过滤部分的枯竭可能是由于与较大的有机颗粒结合,在DNA上进行异养生长。值得注意的是,所有四个回收的属于阿斯加德古菌的Odinarchaeota支系的MAGs在过滤部分也被强烈消耗。Odinarchaeota的形态和生态生理学特征现在还仍然未知,这些发现可能表明与沉积物颗粒或其他微生物有关,也可能与不寻常的形态导致的有效细胞大小增加有关,正如对Prometheoarchaeum MK-D1(阿斯加德古菌的唯一培养成员)观察到的那样。四个ANME-1或三个Desulfofervidales MAGs在过滤样品中都没有强烈的耗损,这与以前的观察一致,即沉积物中的ANME-1经常以单细胞形式出现,相对于ANME-2菌群,往往与SRB形成结构较差的聚合体。
相反,14种MAGs在过滤部分的富集程度超过2倍,表明相对于其他群落成员而言,与沉积物基的关联有限。这14个MAGs代表了12个细菌(7个Proteobacteria、2 个Synergistota、1个Desulfobacterota、1个Poribacteria和1个Thermotogota),以及2个Thermoplasmatota。其中6个MAGs (3个Alphaproteobacteria和3个Gammaproteobacteria)在未经过滤的数据中没有出现,因此被认为是污染,从进一步分析中删除,剩下325个MAGs代表54个门类(图2)。
从2个沉积物芯中回收的325个MAGs描述了Auka喷口在一个地点的微生物群落。为了更好地了解整个喷口区与理化参数有关的沉积物微生物群落结构和分布模式,我们利用16S rRNA基因扩增子测序对2017年和2018年考察期间用遥控潜水器采集的另外29个沉积物push core进行了全区调查,共代表227个样品(图1)。其中22个岩心的孔隙水地球化学profile显示了热液与海水不同程度的混合,表现为镁浓度随深度的增加而急剧下降,钙和钾浓度同时增加。与混合程度不同相一致的是,在沉积物30厘米深处测得的温度变化很大,从10℃到177℃不等,这一范围与Guaymas盆地沉积物的报告相似。孔隙水中氧化氮物种(硝酸盐和亚硝酸盐)的浓度低于检测限,而铵的浓度高达16 mM,可能是有机物热降解的结果。孔隙水硫化物profile经常显示出在沉积物表面以下5至15厘米之间的最高值,高达12 mM。在14个岩芯中,硫酸盐浓度在海床下20厘米处下降到检测极限以下,这是由于微生物对硫酸盐的还原作用和海水与硫酸盐耗尽的热液混合作用的结果。在推断热液流量最大的岩心(如NA091-119和S200-PC1),所有深度的孔隙水硫酸盐浓度始终低于10 mM。
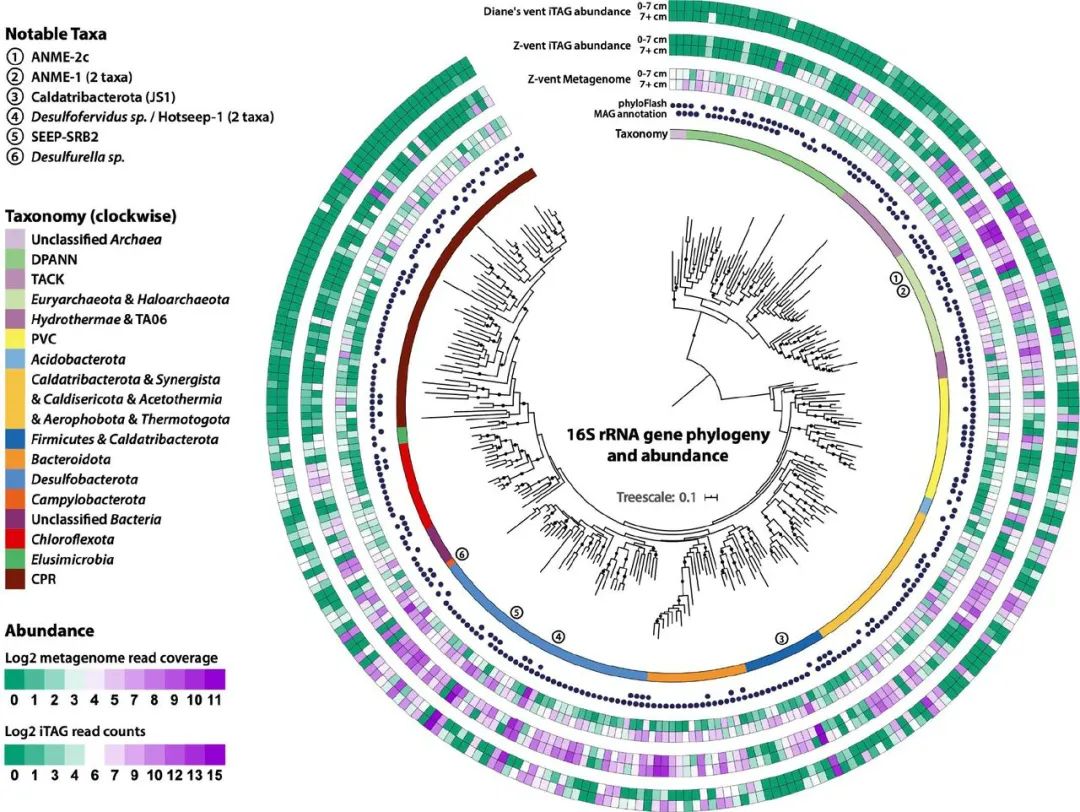
图3 宏基因组和扩增子数据中16rRNA基因的系统发育和丰度。从宏基因组数据中重建的284个16S rRNA基因的系统发生。从内到外,系统发育树周围的同心圆表示:由Silva138分配的系统发育中主要支系的分类,通过phyloFlash恢复序列和/或对检索到的MAGs进行注释,用于宏基因组测序从Z-喷口取回的岩心表面(0-7cm)和深层(7+cm)的丰度。通过扩增子测序从Z-喷口取回的岩心表面(0-7cm)和深层(7+cm)部分的丰度,以及通过扩增子测序从Diane的喷口取回的岩心浅层(0-7cm)和深层(7+cm)部分的丰度。圆圈内的数字突出了正文中讨论的丰富的分类群。
在我们的16S rRNA基因扩增子调查中检测到的分类群在29个push core大致相似。将扩增子序列与使用PhyloFlash从宏基因组中检索的16S rRNA基因以及从选定的MAGs中组装的16S rRNA基因进行比较,显示所有29个核心中最丰富的分类群与从宏基因组测序中恢复的优势分类群之间是一致的(图3)。这表明,从单一地点(2个相邻的核心)组装的MAGs提供了对大喷口区域内微生物群落的代表性见解。Auka沉积物中的总体分布模式表明,硫化物/硫氧化型Campylobacterota(原Epsilonproteobacteria)和假定为异养型的Bacteroidota广泛分布,作为表面微生物垫层组合的一部分,硫氧化型Beggiatoa的恢复有限。在下层沉积物中,与甲烷的硫酸盐依赖性厌氧氧化有关的Dissulfuribacteraceae的ANME-2c古菌和Seep-SRB2硫酸盐还原菌(SRB)在沉积物表面附近占主导地位,ANME-1古菌和Desulfofervidus sp. SRB的联合体在较深的沉积层中高度丰富。这种沿温度和地球化学梯度的ANME生态位分离先前已在Guaymas盆地报告过,在较低温度的岩心观察到ANME-2c,而在较高温度的岩心观察到ANME-1。除了温度,硫酸盐浓度也可能有助于Auka的生态位分离,ANME-1系统型在低硫酸盐浓度对应的地层中占主导地位,这种模式也曾在冷泉中被描述过。在几个岩心(如NA091-118和119)中,扩增子序列变体(ASV)的分布显示ANME-1系统型的进一步深度分层,ANME-1a ASVs与Seep-SRB2系统型共同出现在较浅的地层中,这也与甲烷冷渗漏的观察结果一致。其他高丰度的支系是浅层沉积物中的Desulfobacteraceae,Caldatribacterota(JS1)、Thermoplasmatota(DHVEG-2)和Thermotogota ASV在较深地层中很常见(图3)。与热液平流引起的孔隙水离子浓度的变化相一致,分类群的深度分布在不同的沉积物岩心之间有所不同,较高的推断热液输入对应于ANME-2c的有限检测,ANME-1在浅地层中的丰度较高,而在较深地层中出现了超嗜热菌系(如Methanopyraceae、Thermoprotei)。
16S rRNA多样性分析和宏基因组测序都表明群落在沉积物中按深度进行分层。由于热液的高度混合和观察到的陡峭的热梯度(高达7℃ cm-1),我们预计温度将在塑造群落结构方面发挥主要作用。虽然Guaymas盆地和其他热液地点已经显示出沉积物基微生物群落成员沿温度梯度的相对丰度的广泛趋势,但由于缺乏培养的代表,这些趋势与最佳生长温度(OGT)的关系缺乏大多数分类群。基因组数据正在为像OGT这样的生理特征带来新的启示,在培养的细菌和古细菌的特定基因组特征和OGT之间观察到强烈的相关性。这些知识最近被综合起来,纳入一个OGT预测模型,并用于准确预测系统发育多样的培养微生物的OGT。在此,我们应用该模型的修改版(见方法),并以此来估计从Auka喷口、Guaymas盆地回收的环境MAGs和GTDB中的4000多个古细菌和细菌基因组的OGT。对于几个具有已知OGT或富集温度的微生物,这些基于基因组的预测与报告的数值基本一致。例如,三个Auka Desulfofervidales MAGs的预测OGT为52℃、53℃和60℃,接近实验确定的纯培养中Desulfofervidus auxili的OGT为60℃,GB60支系中两个ANME-1 MAGs的预测OGT为63℃和65℃,也接近GB60富集培养的60℃富集温度。预测的MAGs的OGT与它们的丰度(由reads覆盖率近似)相关,作为沉积物深度的函数,大多数OGT超过50℃的MAGs在两个岩心的>7厘米地层中显示出较高的丰度。值得注意的是,这种OGT深度趋势在DR750-PC80岩芯中不太明显,该岩芯直接收集在局部热液排放附近,而DR750-PC67岩芯则收集在DR750-PC80的远侧,最近的边缘离流体源大约10厘米远(图4)。虽然没有测量这些岩心的沉积物温度,但海底可见的流体排放表明,相对于PC67,DR750-PC80岩心可能暴露在更大的热液流量和更陡峭的温度梯度中,这可能解释了0-7厘米地层中预测OGT值超过50℃的MAG的更高丰度。
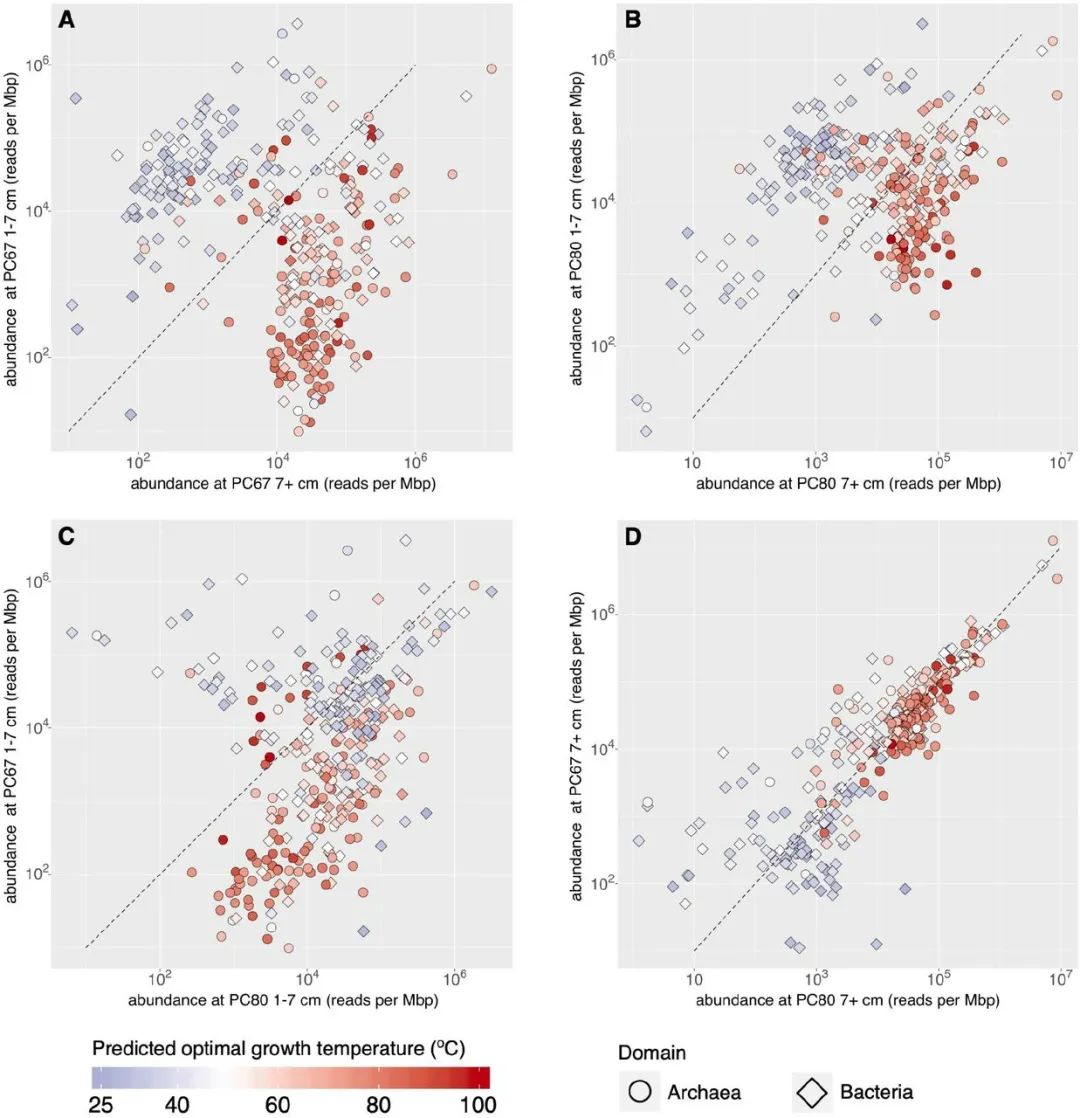
图4 325个Auka MAGs的丰度和预测的最佳生长温度。散点图显示了取样岩心中AukaMAGs的每百万碱基对读数,作为生物体丰度的替代,其点的颜色与每个MAG的预测最佳生长温度(OGT)相对应。虚线代表两个样本之间的丰度相同。A)比较DR750-PC67表层(0-7厘米)和DR750-PC67深层(7+厘米)之间的MAG丰度。B)比较DR750-PC80表层(0-7厘米)和DR750-PC80深层(7+厘米)的MAG丰度。C) 比较两个岩心的表面地层之间的MAG丰度。D) 比较两个岩心深层之间的MAG丰度。
除了预测的OGT和较低地层的丰度增加之间的相关性外,预测的OGT和系统发育之间也有明显的相关性(图2)。使用我们的MAG和来自基因组分类数据库(GTDB)的参考数据,我们更详细地评估了预测OGT的系统发育信号。在分类分配之后,Auka MAGs、最近的Guaymas MAGs,以及来自GTDB(v89)的参考基因组被用来构建具有相应OGT预测的支系特定系统发育,共代表5111个基因组,包括GTDB v89中包括的所有古菌和大多数细菌门。在这14个系统发育中,具有预测的(超)嗜热OGT值的生物体在不同的支系中组合在一起,经常从具有预测的中嗜热OGT值的支系中出现,这表明嗜热适应在生命树的细菌和古菌领域中都很常见,而且一旦获得后经常在一个系中持续存在。此外,有几个例子表明,中温支系是由嗜热性祖先演化而来的,如Nitrososphaeria(原Thaumarchaea),表明嗜热性是一种可逆转的特性。从Auka和Guaymas盆地以前发表的MAG预测的OGT表明,在这些地方的许多门类中都出现了嗜热微生物,Guaymas盆地的一个未培养的Thermoprotei成员的MAG在所有分析的生物中预测的OGT最高,达到117℃。在Auka MAGs中,来自同一Thermoprotei支系的一个成员的预测OGT为111℃(图3)。令人惊讶的是,从Auka回收的四个阿斯加德古细菌MAGs是该支系中唯一预测的(超)嗜热菌,尽管其他几个阿斯加德MAGs是从热液地点回收的。与对培养生物的调查一致,5111个基因组中预测的最大OGT,古细菌(117℃)比细菌(89℃)高得多;(图2),尽管我们注意到GTDB中并非所有的细菌都包括在这个分析中。
除了对高温的特异性适应外,系统发育分析显示,Guaymas盆地和Auka喷口区有大量的群落重叠。为了进一步量化不同地点之间微生物群落的这种重叠,我们计算了Auka和Guaymas数据集的所有MAGs之间的平均核苷酸身份(ANI)。这项分析显示,代表23个细菌和古细菌门的68个Auka MAGs与Guaymas盆地沉积物的MAGs的ANI值大于95%,相当于加利福尼亚湾这些地理位置遥远的喷口区之间近20%的物种重叠(图2和图5A)。另外93个Auka MAGs与Guaymas的MAGs的ANI值在75%和95%之间,进一步显示了广泛的群落相似性。以前的工作表明,Guaymas盆地的群落与玄武岩基和超镁铁质系统的群落不同。事实上,与北太平洋Juan de Fuca海脊深层热液取样的MAGs以及加勒比海镁铁质和超镁铁质喷口所在地Cayman rise的热液的比较显示,ANI超过75%阈值的MAGs与Auka的MAGs分别只有9和12个,而且这两个数据集中都没有ANI>85%的MAGs(图5A)。
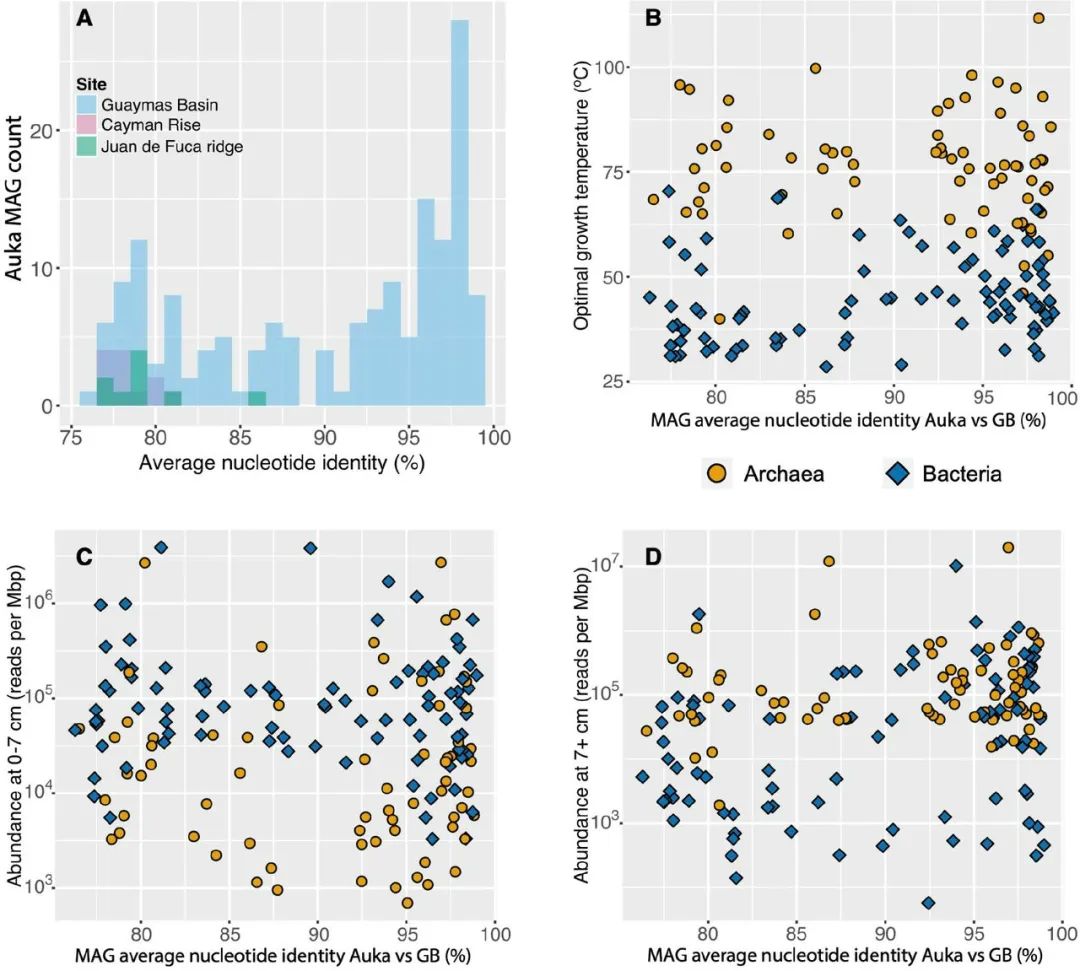
图5 Pescadero盆地和其他热液区之间的群落相似性。A)平均核苷酸同一性(ANI)大于75%的Auka MAGs与从Guaymas盆地(161)、Cayman海隆(12)和Juan de Fuca海脊(9)获得的MAGs的直方图,表明Auka和Guaymas盆地之间有很高的群落相似性。B) Auka与Guaymas盆地(GB)MAG ANI和预测的最佳生长温度(OGT)的散点图,显示OGT和ANI之间没有关联性。C) Auka与GB MAG ANI和表层MAG丰度的散点图,表明表层丰度与ANI之间没有关联性。D)Auka与GB MAG ANI和深层MAG丰度的散点图,表明深层丰度与ANI之间没有相关性。
我们假设,观察到的20%的物种重叠是由于Auka和Guaymas盆地之间微生物种群的持续转移。两地之间400多公里的交流可能是由热液羽流促成的,热液羽流已被证明从Guaymas盆地的喷口向上升起至少900米,并藏有与周围海水不同的微生物群落。此外,通过洋流远距离转移嗜热微生物也有记载,而且开放的海洋已被证明包含热液喷口分类群的 "种子库"。这个 "种子库 "中的几种生物也被证明可以从海水颗粒中培养出来,这表明整个加利福尼亚湾的羽流介导的微生物种群转移是非常可能的。
考虑到热液羽流可能促进了两个盆地之间生物的不断流动,20%的物种重叠表明在散布、转移、殖民或这些方面的组合中进行选择。由于Auka的温度和群落组成之间有很强的相关性,我们调查了预测的MAGs的OGT是否与Auka和Guaymas盆地之间的ANI值相关,但发现没有相关性,在20%的群落中既有嗜中的也有嗜热的(图5B)。此外,ANI值与表层沉积物中的MAG丰度(图5C)或较深地层中的MAG丰度没有相关性,其中既有丰富的分类群,也有罕见的分类群(图5D)。后者的观察结果与以前的工作相反,表明丰富的分类群更可能是世界性的。加利福尼亚湾喷口地点之间具有物种水平重叠的沉积物MAG在系统发育和生理上是多样的,这表明转移和殖民成功的决定因素不是单一的。
基于这些结果,我们假设Auka和Guaymas之间的物种重叠主要是由热液喷口沉积物和深层流体中类似的环境条件所产生的环境位驱动的,选择由转移的微生物群体中的一个子集进行殖民。此外,ANI值的分布可能表明这两个地点的群落内正在进行的种群之间的物种形成。以前的研究表明,成对的ANI值在85%-95%的范围内存在gap,这被用来支持95%的ANI作为物种分界线。虽然Auka和Guaymas MAGs之间有一个明显的ANI值超过95%的高峰,但另外25个MAGs(群落的8%)共享的ANI值在90% - 95%之间,显示出比以前观察到的ANI值中不那么明显gap(图5A)。这些MAGs可能代表了在移民和在新的喷口地点定居后正在进行物种形成的种系。
到目前为止,殖民化成功的基因组决定因素还没有确定,可能是因为这种因素可能是品系特定的(lineage specific)。例如,令人震惊的是,在Auka喷口和Guaymas盆地的沉积物中,同一古菌ANME-1物种的菌株是最丰富的生物体,但其他六个ANME-1 MAG(每个地点三个)属于不同的品系,表明生态位的分化。在更高的沉积物深度分辨率下进行的16S rRNA基因扩增子测序显示,ANME-1品系在Auka的多个沉积物核心中分布不同,支持它们之间的生态位分化。
除了对生物地理学的影响外,主要或全部由在Auka和Guaymas发现的微生物组成的品系对未来的比较基因组学工作有意义。例如,在Auka和Guaymas盆地都发现了几个OGT在50℃和68℃之间的Aerophobota。最近还从其他富含碳氢化合物的环境中检索到该门类的MAG,包括中国南海的甲烷冷渗和墨西哥湾的石油渗漏区,使该门类成为基因组指导的代谢预测和侧重于厌氧碳氢化合物降解的富集培养的研究目标。另一个例子是Desulfobacterota门内的一个深层分支支系,可能代表一个新的类别,最初是在Guaymas盆地发现的,在Auka喷口沉积物的表层有很好的代表性。代表该组的Guaymas盆地MAGs(表示为DQWO01)也包括在最近对Desulfobacterota代谢潜力的大规模分析中。我们从这个支系中恢复了5个MAG,估计完整度为55-92%,估计污染度为0-4.3%。与来自Guaymas盆地的3个MAGs(完整性为55-70%,污染度为1.6-7.1%)相结合,这8个MAGs在脱硫菌群中形成了一个深度分支的单系支系,我们选择该支系进行进一步分析。脱硫菌群的大小在1.3-3.1Mbp之间,用reads映射作为丰度的替代,这些生物在Auka和Guaymas采集的岩心表层富集。它们的预测OGT值(35-41℃)与中温环境中的生态位一致。根据最近提出的将基因组信息作为命名微生物类群的类型材料的建议,我们建议将PB_MBMC_085 MAG(估计完整性为82%,估计污染度为0%)所代表的生物体命名为 "Candidatus Tharpobacterium aukensis",并将包含这八个基因组的支系称为Tharpobacteria。选择Tharpobacterium这个属名是为了纪念Marie Tharp,因为她在洋底测绘和板块构造方面的工作是我们了解热液喷口的关键,而这些生物体就在那里。物种名称aukensis代表Auka,也就是该名称所代表的MAG被发现的地点。
为了研究Tharpobacteria的代谢潜力,我们对从Auka、Guaymas盆地和GTDB v89获得的Desulfobacterota中的427个基因组进行了功能富集分析。该分析表明,Tharpobacteria MAGs编码长链脂肪酸的β氧化和降解苯甲酰-CoA的潜力,表明可能在芳香烃降解中发挥作用。此外,Tharpobacteria可能有能力降解丁酸盐,正如最近报道的Ca. UBA1062目中的Phosphitivorax sp.(Hao等人,2020年),这是Desulfobacterota中的另一个深度分支组。与UBA1062基因组不同,Tharpobacteria MAGs编码NADH脱氢酶(复合体I)、bc1-复合体(复合体III)和一个血红素生物合成途径。我们提出,Tharpobacteria MAGs利用从脂肪酸和其他碳氢化合物的氧化中获得的电子,随后通过复合物I引导到醌池中,以还原一个外周电子接受体(图6A)。然而,这种电子受体的性质从Tharpobacteria MAGs的基因组潜力中不能直接看出。与许多Desulfobacterota不同,Tharpobacteria没有编码使用硫酸盐作为电子受体的能力,无论是功能富集分析还是对基因组的后续人工调查都没有发现利用普通电子受体的末端还原酶。
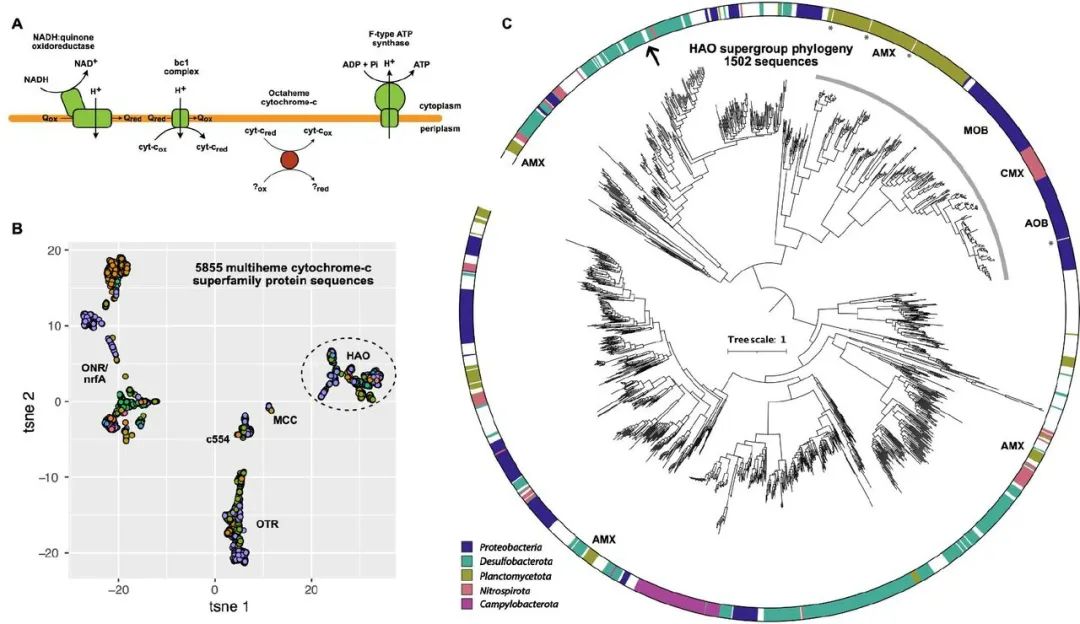
图6 HAO家族蛋白被认为是Tharpobacteria中终端电子受体还原的候选蛋白。A)在Tharpobacteria基因组中检测到的电子传输链组件的示意图概述,其中红色表示拟参与Tharpobacteria中末端电子还原的八价细胞色素c。B)HAO/OTR/ONR/nrfA/MCC/c554结构褶皱家族的5855个蛋白质的排列分数矩阵的t分布随机邻接嵌入(tSNE)表示。每个点代表一个蛋白质序列,按门水平的分类学归属着色。虚线椭圆表示包括在panel C系统发育中的序列。HAO:羟胺氧化还原酶,OTR:八氢硫酸盐还原酶,ONR:八氢亚硝酸还原酶,nrfA:五氢亚硝酸还原酶,MCC:八氢亚硫酸还原酶,c554:四氢细胞色素c554。C)1502个HAO家族蛋白序列的近似最大似然系统发育。外圈表示代表最多的5个门类的分类归属,白色空间表示其他门类。已知参与氮循环的序列用灰色弧线表示。讨论中的Tharpobacteria支系序列用箭头表示, promals3D排列中包含的结构序列用星号表示,参与氮循环的已知支系用3个字母缩写突出。几个HAO家族成员在氨氧化Planctomycetota中的功能尚不清楚。AOB: 氨氧化细菌, MOB: 甲烷氧化细菌, CMX: comammox Nitrospirota, AMX: anammox Planctomycetota.
我们通过分析含有血红素结合图案(CxxCH)的基因,在Tharpobacteria基因组中筛选出其他潜在的末端还原酶,因为血红素可以同时参与电子传递和催化中心。8个MAG中的7个存在一个隶属于多血红素细胞色素-c(MCC)折叠家族的蛋白质,其中包含参与氮和硫循环的特征明确的蛋白质。对从GTDB基因组(v95)检索到的所有5855个MCC家族蛋白的探索性分析表明,这种感兴趣的蛋白是羟胺氧化还原酶(HAO)家族的成员(图6B)。众所周知,HAO家族的蛋白质在氮循环中发挥着关键作用,它首先被确定为好氧氨氧化细菌(AOB)中的一个重要蛋白质,后来又被证明对厌氧氨氧化(anammox)也是必不可少的。来自Campylobacterota的HAO家族蛋白已被证明可以在体外催化亚硝酸盐还原为铵,但其生理作用仍不清楚。值得注意的是,没有一个HAO家族蛋白被建议在氮循环之外发挥作用。然而,我们的分析发现,HAO蛋白家族的成员在许多与氮循环无关的生物体的基因组中,横跨65个门类(GTDB v95),最常见于Desulfobacterota。对1502个HAO家族蛋白的系统发育分析表明,那些在好氧和厌氧铵氧化中具有已知功能的蛋白形成了一个单系的支系。Campylobacterota的HAO形成一个单独的支系,而功能不明的蛋白质在家族中形成其他几个支系,Tharpobacteria的蛋白质与其他Desulfobacterota的蛋白质聚集在一个支系中(图6C)。基于这种分布,以及Auka沉积物中没有可检测到的氧化氮物种,我们假设这种蛋白催化硫物种的还原,而不是氮。这是有先例的,因为MCC折叠家族的其他成员,如亚硫酸盐还原酶mccA和八价四硫酸盐还原酶,已经显示了硫循环。根据其在整个MAG中的普遍性,我们提出这种HAO家族蛋白在Tharpobacteria支系中催化末端电子受体的还原。
考虑单个Tharpobacteria MAGs使用不同电子受体的可能性也很重要,因为有几个其他蛋白复合物代表潜在的候选者作为电子流的最终还原部位。最突出的是,几个Tharpobacteria MAGs编码钼蝶呤氧化还原酶,这是许多厌氧代谢的关键复合物。然而,这些钼蝶呤氧化还原酶复合物都没有已知的功能,或在8个基因组中的3个以上保守。此外,还有其他几个含细胞色素的蛋白质,可能是特定MAG中终端电子受体还原的候选位点。需要进一步的研究来解决这个深度分支的Desulfobacterota支系的新陈代谢问题,但是这个宏基因组分析提供了一个切入点,可以从分离的生物体中进一步表征密切相关的HAO家族蛋白,以及设计有针对性的富集,转录组分析,或使用含有Tharpobacteria的热液喷口样品进行稳定同位素探测实验。
讨论
基因组解析的宏基因组学正在迅速产生整个生命树上的生物的基因组信息,这对未培养系的生物的生态学和生理学的假设很有价值,并为后续的实验研究提供目标。我们对Auka沉积物的分析揭示了一个高度多样化的微生物群落,包括许多与沉积物中的热液喷口有关的未被研究的系。我们对其中一个品系进行了深入研究,我们将其命名为Tharpobacteria,发现呼吸性脂肪酸的降解与一个未知的电子受体相联系,为此,我们认为这个未知的电子受体是一个MCC折叠家族蛋白,并催化还原一个硫化合物。这为实验验证提供了一个明确的目标,确认我们的假设将对生物硫循环的解释产生影响。
除了基因功能外,调查参与Auka和Guaymas的殖民成功的基因组因素是未来工作的一个令人兴奋的方向,也是使用MAGs比更经常用于生物地理学研究的16S rRNA基因扩增子分析的一个明显优势。加利福尼亚湾的地理和地质环境使该地区特别适合作为热液喷口生物地理学的模型系统。狭窄的海湾限制了海流,从而限制了热液羽流的方向,而且随着与海湾口距离的增加,沉积物的厚度也在增加,这使得两个已知的喷口地点之间的条件有所区别。位于Guaymas段和Pescadero段之间的Carmen段和Farallon段的扩张中心也可能藏有尚未发现的热液喷口。
此外,加利福尼亚湾的沉积物基的热液喷口为进一步发现(超)嗜热生物提供了一个很好的研究场所。Auka(111℃)和Guaymas(117℃)的生物的最大预测OGT大大高于实验确定的最高OGT值,即Pyrolobus fumarii的106℃和在高压下生长的Methanopyrus kandleri的105℃。有趣的是,M. kandleri的预测OGT是98℃,与它在环境压力下观察到的最佳温度相同,而Pyrolobus fumarii的OGT预测是102℃,比报告的OGT略低。Strain 121的预测最佳温度为103℃,没有公开的基因组序列;但是Pyrodictium abyssii的预测OGT为98℃,是与基因组排序最接近的生物体,与实验观察一致。预测OGT高于实验观察到的最高OGT的MAGs并不局限于一个支系,而是分布在Thermoproteota(以前的Crenarchaeota)的几个支系中。Thermoproteota的采样严重不足,Auka和Guaymas的MAGs加起来占本研究中分析的Thermoproteota基因组的40%。这表明进一步取样可能会产生比这里预测的OGT更高的生物体,并表明生命的温度上限可能比目前已知的要高得多。加利福尼亚湾热液喷口遗址沉积物的原位和体外实验都可以推动我们对生命温度上限的认识。最后,OGT预测和基因组分辨宏基因组学提供了一个强大的组合来研究嗜热性的进化历史。我们的分析表明,嗜热性在细菌和古细菌中都有频繁的进化,这表明嗜中生物适应了高温环境的殖民。生命之树中各系的基因组代表迅速增加,使得系统发育组学与最佳生长温度预测相结合,成为有关地球上生命产生和多样化的条件的辩论中一个令人兴奋的角度。
参考文献
Daan R. Speth, Feiqiao B. Yu, Stephanie A. Connon, Sujung Lim, John S. Magyar, Manet E. Peña-Salinas, Stephen R. Quake, Victoria J. Orphan. 2022. Microbial communities of Auka hydrothermal sediments shed light on vent biogeography and the evolutionary history of thermophily. The ISME Journalhttps://doi.org/10.1038/s41396-022-01222-x
作者简介
(附注:我认为作者背景介绍可以不用翻译,直接用英文)

Victoria Orphan is the James Irvine Professor of Environmental Science and Geobiology at the California Institute of Technology. She received her B.A. in aquatic biology from the University of California, Santa Barbara in 1994, and her Ph.D. in the Ecology, Evolution and Marine Biology program at UCSB in 2001. During 2002–2004, she served as a National Research Council postdoctoral fellow at the NASA Ames Research Center before joining the geobiology faculty in the Division of Geological and Planetary Sciences at Caltech in 2004. She was named the James Irvine Professor in Environmental Science and Geobiology in 2016.
Dr. Orphan’s research incorporates molecular, microscopy and geochemical techniques to study the ecophysiology and interspecies interactions within microbial communities, with an emphasis on microbial assemblages involved in the cycling of methane, sulfur and nitrogen in anoxic ocean ecosystems, deep subsurface and extreme environments. She helped to pioneer novel stable isotope applications using secondary ion mass spectrometry (SIMS and nanoSIMS) for measuring single cell activity and metabolic potential of uncultured microorganisms in environmental samples and has applied these techniques to develop new understanding into the syntrophic interactions and ecophysiology of methane-oxidizing archaea and sulfate-reducing bacteria driving the globally important process of anaerobic oxidation of methane in anoxic ocean sediments. Orphan is a member of the American Academy of Microbiology and was recently named a 2016 MacArthur Fellow.

Daan Speth is a postdoc at Caltech, working on the microbial communities in diverse extreme environments. He applies a mix of bioinformatics and wet lab methods to gain insight in the role of microbes in the environment. Prior to his work at Caltech, Daan obtained his Ph.D. from the Radboud University Nijmegen in the Netherlands, where he used molecular methods to characterize the microbial communities in nitrogen cycling, focusing on anaerobic ammonium oxidizing organisms. Daan was a participant on the 2017 E/V Nautilus cruise to Pescadero Basin, and is excited to revisit the site and apply the knowledge gained from this previous visit to further our understanding of the microbes of Pescadero Basin during this cruise.
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
文献阅读 热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
点击阅读原文,跳转最新文章目录阅读