物种入侵改变了二十年淡水时间序列的微生物群落物候特征
Species invasions shift microbial phenology in a two-decade freshwater time series
翻译:周之超@UW-Madison

Article,2023-3-7,PNAS, [IF 12.78]
DOI:10.1073/pnas.2211796120
原文链接:https://www.pnas.org/doi/10.1073/pnas.2211796120
第一&通讯作者:Robin R. Rohwer
主要单位:德克萨斯大学奥斯汀分校综合生物学系
- 摘要 -
Abstract
入侵物种会给生态系统带来突然的变化,但它们对微生物群落的影响经常被忽视。我们将20年的淡水微生物群落时间序列与浮游动物和浮游植物计数、丰富的环境数据以及6年的蓝藻毒素时间序列配对。我们观察到了强烈的微生物物候学模式,这些模式受到了刺水蚤(Bythotrephes cederströmii)和斑马贻贝(Dreissena polymorpha)的入侵的干扰。首先,我们检测到了蓝藻物候学的变化。在刺水蚤入侵后,蓝藻优势逐渐提前到清水中;在斑马贻贝入侵后,蓝藻丰度甚至更早地进入了硅藻为主导的春季。在夏季,刺水蚤入侵引发了一系列变化,浮游动物多样性下降,而蓝藻多样性增加。其次,我们检测到了蓝藻毒素物候学的变化。在斑马贻贝入侵后,microcystin 在初夏时期增加,毒素产生的持续时间延长了一个多月。第三,我们观察到了异养细菌物候学的变化。拟杆菌门和acI Nanopelagicales类的成员有不同程度的增加。细菌群落的变化比例因季节而异;在春季和清水群落中,刺水蚤入侵降低了清水的穿透度,导致变化最大;夏季群落在斑马贻贝入侵后虽然蓝藻多样性和毒性发生了变化,但变化最小。建立的模型框架确定了入侵作为观察到的物候学变化的主要驱动因素。这些长期的入侵介导的微生物物候学变化展示了微生物与更广泛的食物网络的相互关联以及它们对长期环境变化的易感性。
研究意义
微生物群落通常作为微生物环路的一部分单独研究,与更广泛的食物网分开。利用长达二十年的淡水时间序列,我们探究了两个物种侵入(刺水蚤和斑马贻贝)是否也影响了微生物群落,因为微生物群落有明显的季节模式,所以我们特别关注了季节响应。我们发现,蓝藻在一年的早期增加,夏季蓝藻多样性也增加了。随着毒素产生时间的增加,蓝藻毒素也增加了。在异养细菌群落中,一些微生物种群在亚系和季节内保持一致,而其他微生物种群则分化开来。这些发现说明了季节背景的重要性,并凸显了细菌与更广泛的食物网之间的相互联系。
-引言 -
入侵物种对生态系统有广泛的影响,经常重新构建食物网,破坏营养循环,它们甚至比人为的非生物变化更具破坏性。然而,物种入侵对整个微生物群落的影响却很少被考虑。微生物通常与后生动物湖泊生态分开考虑;细菌群落被认为与更广泛的食物网相互作用,成为微生物循环的一部分,浮游植物产生的溶解有机物返回到更高的营养级。消耗有机物的细菌又被纤毛虫和纳米鞭毛虫所消耗,而纤毛虫和纳米鞭毛虫又被微型浮游动物所吃,从而将微生物群落与更高的营养水平联系起来。虽然这种微生物食物网经常与后生动物食物网分开研究,但我们假设后生动物物种的入侵会改变细菌群落。
我们从美国威斯康星州的富营养化温带湖泊门多塔湖Lake Mendota收集了20年的微生物群落时间序列(2000至2019年,496个样本)。这期间包括两次后生动物物种入侵:2009年捕食性浮游动物刺水蚤(Bythotrephes cederströmii)和2015年的斑马贻贝(Dreissena polymorpha)。刺水蚤的入侵引发了食物网级联反应,导致水体透明度下降1米,因为刺水蚤对浮游动物的捕食增加,导致对浮游植物的放牧压力减少。这种影响在春季清水阶段特别强烈,其强度和持续时间减少。斑马贻贝的入侵引发了底栖浮游动物和浮游植物丰度增加300%,它们本身变得丰富,足以每45天过滤一次表层体积。斑马贻贝增加过滤,但它们也会通过选择性地保留真核生物藻类和将蓝藻释放回湖中,以及通过改变营养物质的比例而使蓝藻水华恶化。在门多塔湖,斑马贻贝在任何方向上都没有影响水层的透明度。中等时间序列的干扰建立了一个自然实验,我们通过这个实验来探索后生动物物种入侵对细菌群落的影响。
门多塔湖是一个温带的昏暗湖泊,其生态学遵循一致的季节性模式(物候学)。湖泊在冬季结冰,结冰后是春季的混合和硅藻的繁殖期。随着水的变暖,浮游动物的捕食增加,导致短暂的高水清期,当浮游鱼类开始吃浮游动物时,高水清期结束。在这个清水阶段之后,硅藻让位给蓝藻,蓝藻在整个夏季持续存在。在夏季,水体是热分层的,底层出现缺氧现象,而上层则出现营养物质的减少。当秋天气温下降时,门多塔湖混合,并保持混合,直到结冰。在微生物群落组成中也观察到了季节性模式,这些季节性周期可以掩盖长期变化。因此,我们将我们的时间序列分成季节,并寻找细菌物候学的变化。
在此,我们确定了描述细菌物候学的季节,然后确定蓝藻、蓝藻毒素和异养细菌的物候学变化。这些观察到的物候学变化是应对入侵物种的多年代微生物变化的直接观察。
- 结果 -
我们通过16S核糖体RNA基因扩增子测序来描述微生物群落的组成(961个样品,496个样品日期)(图1)。采集的水体包括水柱的顶部12米,这与混合上层相近。除了基于测序的相对丰度外,我们还从北温带湖泊长期生态研究计划(NTL-LTER)中获得了环境数据,包括水的物理和化学测量以及基于显微镜的浮游动物和浮游植物计数。
微生物物候学。为了进行跨年度比较,我们利用环境变量定义了湖泊季节,并对同一季节内的样本进行比较。我们按季节而不是按朱利安日期进行跨年度比较,以区分每个季节的群落组成的变化和季节性时间的变化。我们根据环境数据创建了多个潜在的季节定义,然后选择了最能代表微生物物候学的定义。我们将非度量多维缩放法(NMDS)应用于用中心对数比(CLR)转换的相对丰度的phi距离指标计算的样本距离矩阵。为了选择与微生物群落最相关的季节定义,我们选择了能使NMDS图中的季节边界明显分离的定义(图1)。按我们选定的季节定义分组的样品,在每个季节边界,组内的变化明显小于组间的变化(相似性分析(ANOSIM)的显著度≤0.001)。
最能描述微生物物候的季节定义是冰期、春季、清水期、初夏、夏末和秋季(图1)。冰期是由整个中央湖区的连续冰盖的开始和破裂决定的。春季以脱冰开始,以清水开始结束,横跨一个时期,包括春季硅藻盛行。清水的定义是基于水的透明度测量,是一个由高浮游动物掠食压力驱动的年度阶段。初夏是一个不断增长的分层期,以清水为界,下层缺氧延伸到12米以上。晚夏是一个强分层和缺氧期,以秋季混合结束。我们将混合定义为表层和下层平均温度的差异<3℃。秋季以混合开始,以结冰结束。
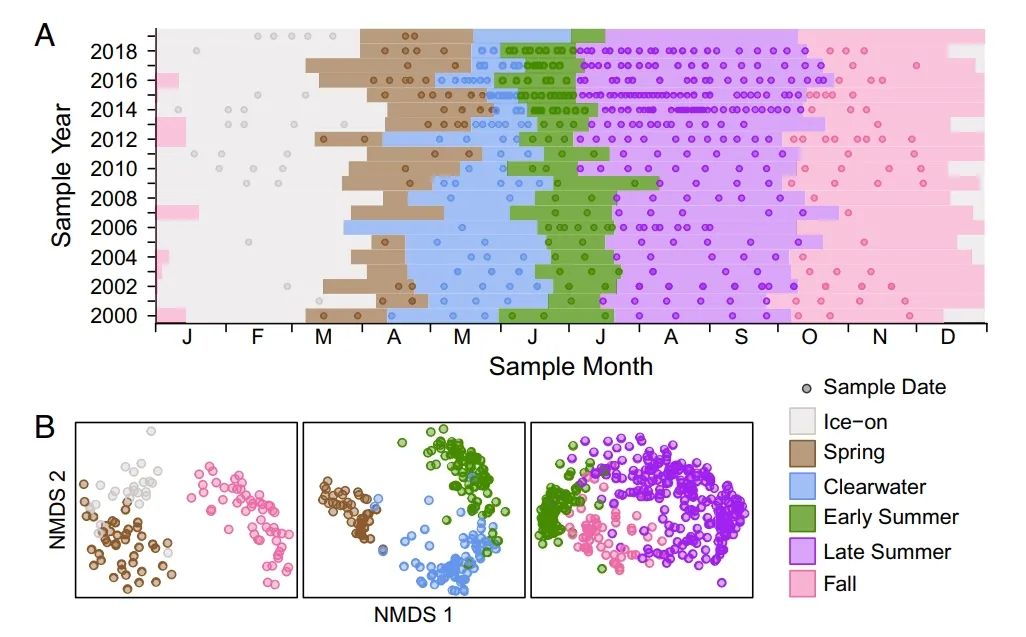
图1. 样品日期和微生物物候学。
(A) 采样日期用点表示,季节持续时间用阴影表示。(B) CLR转换后的细菌群落组成NMDS图。点代表样品日期,颜色代表季节。三个季节在每个NMDS图中进行了比较,以突出季节的界限。所有NMDS的压力值都≤0.1。
蓝藻物候学的转变。鉴于刺水蚤对清水物候学的明显破坏,即持续时间和强度的缩短,我们首先寻找春季浮游植物物候学的变化。从历史上看,清水期的结束标志着从硅藻为主的系统向蓝藻为主的系统的过渡。我们发现,在刺水蚤入侵后,蓝藻开始在清水期出现(图 2A)。在清水期,我们没有看到叶绿体相对丰度或硅藻计数的类似增加,这表明向蓝藻主导地位的转变更早。我们进一步发现,在斑马贻贝入侵后,蓝藻甚至在清水期开始前就开始出现了(图 2A)。
计数数据证实,蓝藻的生物量增加了两倍,增长到浮游植物总量的10%以上。蓝藻的这种较早出现的情况描述了种群的kingdom水平转变,从真核生物藻类主导的时期转变为包括蓝藻的时期。在确定春季物候学的这些变化后,我们接下来寻找刺水蚤入侵对夏季蓝藻物候学的影响。刺水蚤入侵后,夏季和秋季的蓝藻丰度(相对于微生物群落)没有变化。然而,夏末季节的蓝藻多样性有所增加(图 2B)。在精细和粗略的分类水平上都观察到了蓝藻多样性的增加,包括粗略的order水平(图 2B)。有可能的是,夏季多样性的转变可以解释为蓝藻为主的季节较早开始,导致高蓝藻多样性较早开始。然而,春季的蓝藻入侵是由属于 Aphanizomenon 的单一扩增子序列组成的,而不是初夏典型的更复杂的种群。此外,我们观察到夏末浮游动物多样性的同时变化;在刺水蚤入侵后,浮游动物多样性下降(图2B)。因此,我们将蓝藻夏季多样性的转变归因于源于浮游动物群落的多样性的级联转变。浮游动物的较低多样性可能导致了较窄的放牧压力,使更广泛的蓝藻得以繁衍。
接下来,我们寻找夏季蓝藻群落中因斑马贻贝入侵而产生的变化。我们首先比较了斑马贻贝前后的蓝藻总丰度,但没有看到相对丰度或生物量的强烈和一致的变化。我们也没有观察到蓝藻群落组成的强烈转变。蓝藻可产生强效毒素,但蓝藻丰度并不总是与蓝藻毒素浓度相关,这表明毒素浓度还可能因入侵而发生变化。
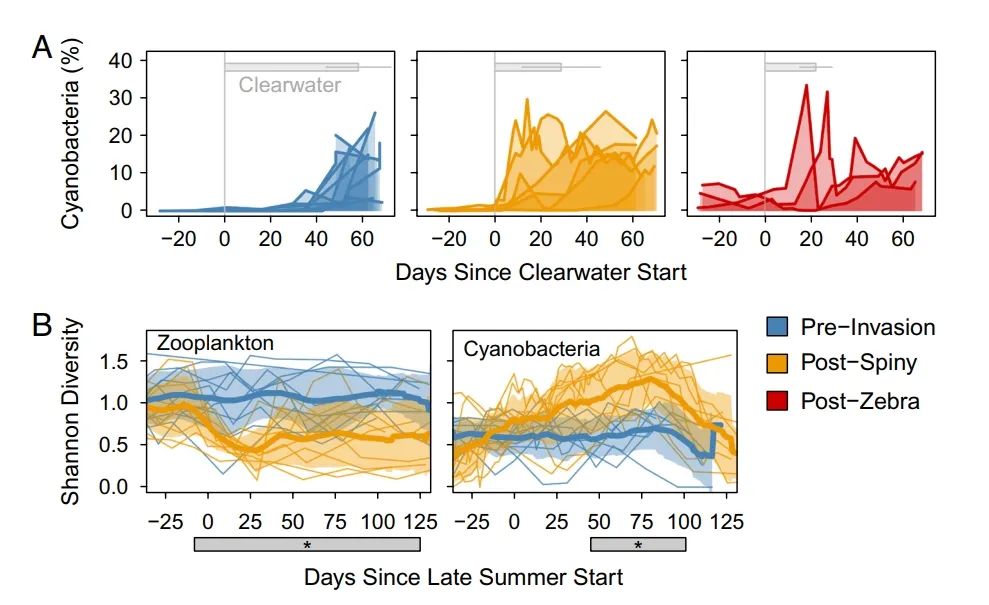
图2. 蓝藻物候学的转变。
(A) 蓝藻的春季相对丰度以清水后的天数排列。清水期的平均和SD持续时间用灰色条表示。蓝色代表2000年至2009年的入侵前时期,橙色代表2010年至2015年的刺水蚤后时期,红色代表2016年至2018年的斑马贻贝后时期。(B) 夏季浮游动物和蓝藻的多样性。粗线代表平均香农多样性,阴影代表SD。细线代表个别年份。这里的橙色后刺水蚤时期包括2010至2018年。灰色的星形区域表示平均多样性的显著差异时期(P < 0.05)。蓝藻的多样性显示在order上,浮游动物的多样性显示在生态相关的分组中,并去除刺水蚤的数量。
蓝藻毒素物候学的转变。为了研究斑马贻贝对蓝藻毒性的影响,我们收集了斑马贻贝入侵前后3年共246个样本的毒素时间序列。我们使用高效液相色谱与串联质谱法(HPLC-MS/MS)测量了hepatotoxin microcystin(MC)毒素和生物活性肽anabaenopeptin(Apt)毒素。我们观察到在初夏期间,anabaenopeptin毒素减少了三倍,microcystin毒素同时增加了三倍(P < 0.05)(图3A)。微囊藻科(Microcystaceae)被认为是门多塔湖中主要的microcystin毒素生产者,尽管它也能生产anabaenopeptin。然而,微囊藻科的相对丰度并没有改变。这表明,从 anabaenopeptin 到 microcystin 的转换是由于比 Microcystaceae 的丰度更复杂的生态驱动因素,并说明了入侵影响的复杂性。这种毒素浓度的转变对人类健康有影响,因为microcystin是一种比anabaenopeptin更强效的毒素。
在观察到初夏microcystin毒素的增加后,我们接下来探讨了microcystin毒素产生的物候学(图3B)。总的毒素浓度在不同的年份是不同的,所以对于每一年,我们用该年的最大测量浓度来归一化总的microcystin。我们发现,在斑马贻贝入侵后,毒素产生的持续时间(定义为毒素至少为年度最大毒性的15%)增加了53±9 d,或170±10%。(P<0.001)(图3C)。这种增加是由于夏末季节的延长,以及毒素的产生进一步延伸到初夏和秋天的季节。尽管蓝藻的丰度和多样性没有变化,但我们观察到这些毒性的增加。这可能可以通过基因表达的变化来解释,这种变化足够大,以至于microcystin毒素基因mcy的丰度并不能很好地预测microcystin毒素的浓度。另一个可能的解释是优先保留无毒菌株或细胞,而将有毒细胞释放回水体。以前发现过斑马贻贝优先保留无毒的微囊藻菌株而不是有毒的菌株。
综上所述,蓝藻物候学在应对两种后生动物入侵时发生了变化,在时间、多样性和毒性方面都有变化。
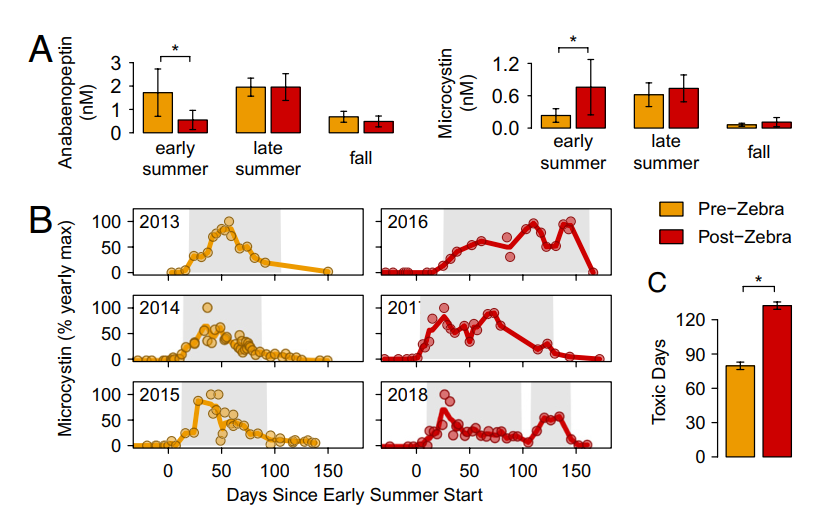
图3. 藻类毒素表征的变化。
橙色代表斑马贻贝入侵前的2013至2015年,红色代表斑马贻贝入侵后的2016至2018年。星代表显著差异(P < 0.05)。(A) 在有毒性的季节里,ananbaenopeptin和microcystin毒素的浓度。(B) microcystin毒素浓度按年度最高浓度归一化,以比较年度模式。阴影区域代表毒素产生的持续时间,定义为毒素出现在最大毒性的≥15%的日子。(C) 斑马贻贝入侵前后的毒素产生时间比较。
异养细菌季节性的转变。为了探索入侵的影响是否进一步扩展到异养细菌群落,我们使用NMDS分析CLR转换后的Phi异质性来比较入侵前后每个季节的异养细菌群落。我们观察到基于入侵状态的适度分组,ANOSIM分析证实,在所有季节的两次入侵中,组内差异小于组间差异(ANOSIM显著度= 0.001)。
为了确定哪些细菌对群落组成的变化负有责任,我们在应用CLR转换以考虑测序数据的相对化性质后进行了差异丰度分析。我们使用一个广义线性模型来测试每次入侵前后丰度不同的生物,我们寻找每个季节内的变化。当一个操作分类单位(OTU)的效应大小>0.5时,我们认为它的丰度有差异,我们通过检查相对丰度随时间的变化,手动确认这个效应大小截止点的生态学意义(图4中的例子)。
为了评估哪些季节性群落最容易受到变化的影响,我们查看了群落中丰度不同的OTU的比例。为了更好地反映丰度不同的OTU的生态影响,我们通过其平均相对丰度将OTU归一化。入侵对季节性群落组成的影响程度不同。例如,刺水蚤对春季和清水期群落变化的比例影响最大,平均群落的38%变得不同丰度(图4 C,左)。这意味着,除了改变清水的季节性时间外(5),刺水蚤还改变了异养细菌群落。同时,斑马贻贝对夏末微生物群落的影响最小,只有4%的平均群落变得不同程度的丰富(图4 C,右)。夏末微生物群落的差异丰度生物比例最小,总体差异丰度的OTU也最少(图4)。夏末群落也有最高的阿尔法多样性,而高生物多样性与生态系统的稳定性有关。这种高多样性有可能使夏末的生态系统更加稳固。入侵影响的季节性差异强调了物候学背景的重要性。
在丰度不同的微生物中,拟杆菌门的OTU是斑马贻贝入侵的“赢家”(图4A)。这些获胜者包括来自bacI、bacII、bacIII和bacIV谱系(Chitinophagales、Flavobacteriales和Cytophagales目)的丰富的OTU。然而,在分类谱系或不同季节内,丰度差异的大多数变化并不一致。例如,在Frankiales目的谱系中,Nanopelagicaceae(acI)倾向于获胜,而acTH1和acSTL倾向于失败(图4B)。
拟杆菌门经常与颗粒相关,在刺水蚤入侵和斑马贻贝入侵后,拟杆菌门OTU在很大范围内的数量有变化。相比之下,Frankiales目是由小型、自由生活的细菌组成的,并且包含赢家和输家的OTU。Frankiales目的非均匀反应表明,它们占据了不同的生态位空间。此外,似乎acI的生态位空间可能取决于季节。acI谱系是寡营养微生物,acI-A和acI-B在清水和初夏期间倾向于获胜,尽管它们全年都很丰富,而acI-C在秋季丰富,也倾向于在秋季获胜。AcTH1和acSTL也是小型的、自由生活的Frankiales目细菌,但对它们的生态和代谢知之甚少。在两次入侵后的所有季节中,它们由许多丰富的入侵失败者组成,这表明它们的生态位对季节的依赖性较小,与它们的近亲不同。
综上所述,异养细菌的物候学被后生动物物种入侵所改变。一些生物在门水平内和跨季节表现出一致的反应,而一些生物在目水平内和季节间表现出不同的反应,这表明一些生态位在广泛变化,而其他生物经历了季节性的变化。总的来说,细菌群落经历的变化是季节性的,一些季节性定义的群落比其他群落对变化更稳定。
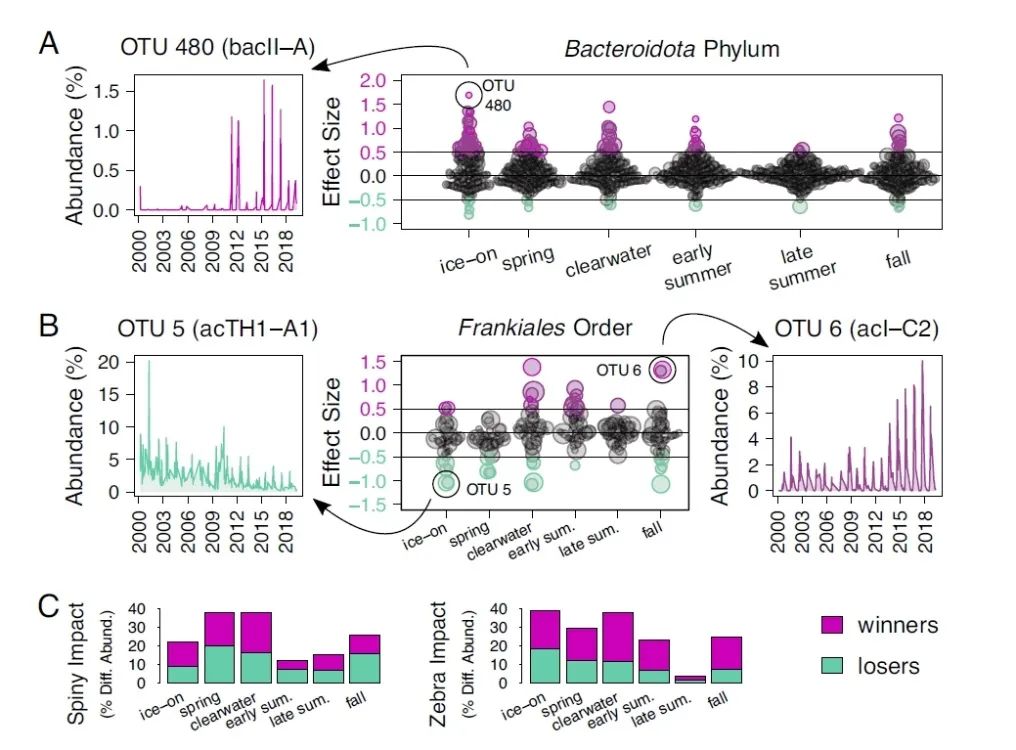
图4. 异养菌物候学的转变。
用广义线性模型计算CLR转换后的丰度差异。粉红色代表不同程度增加的“赢家”,蓝绿色代表不同程度减少的“输家”。点代表OTU,点的大小以OTU的平均丰度为对数。(A, 左) 一个具有正效应大小的OTU的相对丰度随时间变化的曲线例子。(右) 斑马贻贝入侵前后的类杆菌群OTU丰度差异的效应大小。(B, 中) 斑马贻贝入侵前后Frankiales目OTU的不同丰度的效应大小。右边和左边是赢家和输家OTU丰度随时间变化的例子。(C) 每个季节的微生物群落随时间变化的丰度百分比。在计算群落变化的百分比之前,OTU被其平均丰度归一化。左边显示的是刺水蚤入侵的影响,右边显示的是斑马贻贝入侵的影响。
物种入侵是变化的驱动力。为了比较物种入侵与其他环境驱动因素的重要性,我们在一个建模框架中评估了与入侵状态、景观变化和气候变化有关的指标。我们利用入侵状态、磷负荷、冰雪持续时间和夏季炎热天数,预测了蓝藻发生与清水发生之间的时间差(图2A)和赢家acI-B OTU 1的CLR转换丰度(图4B)。我们使用Akaike信息准则(AIC)来确定哪些驱动因素被包括在表现最好的模型中。刺水蚤和斑马贻贝的入侵状态包括在所有的最佳模型中,这强调了物种入侵作为微生物物候学变化的驱动因素的重要性。夏季高温天数和平均磷负荷也包括在一些表现最佳的模型中。这表明,尽管在我们的数据集的19年时间范围内,物种入侵是微生物变化的强大驱动力,但气候和景观是微生物变化的交互驱动力。
- 讨论 -
在长达一个世纪的时间范围内,气候变化正在改变北半球湖泊的物候学。冬天在缩短,夏天的分层和缺氧现象在增加,极端天气变得更加普遍。具体到门多塔湖,冰期和清水期正在缩短,而分层期和缺氧期正在延长。我们认为,湖泊微生物群落也会因气候变化而发生变化,因为湖泊微生物群落具有追踪这些季节变化的物候学模式。此外,我们直接观察到,食物网介导的季节性变化可以改变微生物群落的时间、组成和毒性。因此,气候变化的交互驱动因素在更长的时间范围内改变季节,也可能会改变微生物的物候。
此外,刺水蚤的入侵本身是由气候异常驱动的。以前在门多塔湖的工作发现,一个异常凉爽的年份允许刺水蚤的潜伏种群爆发,像这样的极端天气预计会随着气候变化而增加。有可能刺水蚤介导的食物网变化也为斑马贻贝的入侵铺平了道路。基于湖上大量的休闲船交通,斑马贻贝可能有多次引入门多塔湖的机会,所以它们在2015年之前被引入并作为一个低丰度的潜伏种群存在是合理的。一个入侵物种的建立,可以破坏一个生态系统的稳定,为更多的入侵做准备,或引发现有的潜伏种群的中断。气候异常触发了入侵的刺水蚤潜伏种群的中断,由此产生的食物网破坏可能为斑马贻贝的建立铺平了道路。这些入侵的影响一直延伸到细菌群落,说明了物种入侵和气候变化的相互作用的驱动因素如何产生复杂而深远的影响。
有害的蓝藻水华被预测将随着温度升高、二氧化碳含量增加和雨量增大而增加。我们观察到蓝藻进入清水和春季季节的时间较早。在其他湖泊中,已经观察到制度性的变化,比如寡营养系统切换到由蓝藻主导的新稳定状态。我们有可能正在观察到在季节性层面上向新的稳定状态过渡的开始。在已经由蓝藻主导的夏季,我们发现差异丰度最小的微生物。这表明,即使在其他季节达到临界点,群落也不太可能在最需要的时候发生转变:在受有毒蓝藻水华困扰的夏季。
长期变化很难与短期变化和季节性周期区分开来,这种现象被称为“看不见的现在”。对微生物群落近20年的观察,使我们能够区分一致的物候模式,并确定单独的十年期、由入侵引起的转变。像我们这样的时间序列的建立和延续是直接观察环境变化的长期影响的唯一途径。我们的研究发现,微生物群落对长期、十年的变化很敏感,特别是对入侵物种的连带影响。这些影响包括物候学的许多方面,从时间和丰度,到多样性和群落组成,到人类健康和蓝藻毒性。
参考文献
Species invasions shift microbial phenology in a two-decade freshwater time series.Proc Natl Acad Sci U S A. 2023 Mar 14;120(11):e2211796120. doi: 10.1073/pnas.2211796120. Epub 2023 Mar 7.
- 作者简介 -
第一作者

德克萨斯大学奥斯汀分校
Robin Rohwer
NSF Postdoctoral Fellow (整合生物学),德克萨斯大学奥斯汀分校
通讯作者

威斯康星大学麦迪逊分校
Katherine (Trina) McMahon
教授
Katherine (Trina) McMahon教授是威斯康星大学麦迪逊分校的维拉斯杰出成就教授,在土木与环境工程系和细菌学系分别任职。她在伊利诺伊大学厄巴纳-香槟分校获得学士学位和硕士学位(分别为1995年和1997年),在那里她与Lutgarde Raskin教授(现在在密歇根大学安娜堡分校)一起研究厌氧消化器微生物生态学。她于2002年在加州大学伯克利分校获得环境工程博士学位,与David Jenkins和Jay Keasling教授合作研究活性污泥中生物除磷的微生物生态学。2003年搬到威斯康星大学麦迪逊分校后,她开始了淡水湖微生物生态学的新研究,但也继续从事生物废水处理的工作。在这两个系统中,Trina运用生态系统生物学方法研究微生物之间的相互作用、群落组装、生态生理学和生态系统功能。她努力利用 omics和 post-omics工具,包括宏基因组、宏转录组、代谢组,以及在亚细胞水平和群落范围内的建模,将基因与生态系统联系起来。除了她对广义的水生微生物组的研究外,Trina还热衷于pre-faculty 和junior faculty围绕教学的专业发展。她是威斯康星大学麦迪逊分校Delta Program的联合faculty主任,该计划为研究生和博士后提供创新和严格的课程。她在2017年被环境工程和科学教授协会授予ARCADIS/AEESP研究前沿奖,并在2018年当选为美国微生物学会会员。Trina是ASM杂志mSphere的高级编辑。她曾担任MEWE秘书(2009-2013),并继续在管理委员会任职(2005-现在)。
猜你喜欢
iMeta简介 高引文章 高颜值绘图imageGP 网络分析iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读