文章标题:Designing antimicrobial peptides using deep learning and molecular dynamic simulations
代码:https://github.com/gc-js/Antimicrobial-peptide-generation
一、问题
PandoraGAN使用手动策划的130个高活性肽的训练数据集,其中包括来自已知数据库(如AVPdb)和文献的肽,以生成新的抗病毒肽。PepGAN(一种肽专门化网络)来生成高活性AMP,其强度是氨苄西林的两倍。PepVAE从学习到的潜在空间的不同区域进行采样,并允许以最小的输入参数可控地生成新的AMP序列。这些模型用于生成AMP而不考虑其二级结构的稳定性,尽管这与AMP的抗菌活性高度相关。
sAMPpredGAT用于AMP识别的预测器,GAT框架利用结构信息、演化特征和序列特征,从图中提取判别特征。最后,将优化后的特征输入到输出层以识别AMP。为识别sAMP, sAMP-PFPDeep 通过两个DNN,即VGG-16和Resnet-50,利用位置、频率和其他物理化学特征。此外,深度学习模型已经在各种应用中证明了它们的能力。
先前的实验研究表明,AMP的功能与二级结构(如螺旋或β -链成分)的稳定性高度相关;因此,将二级结构的可用性和肽的稳定性作为选择生成肽的重要依据。
二、Materials and methods
1、Data set collection and preprocessing
AMPs
大多数AMP的长度大于10个氨基酸,并且含有大于30个氨基酸的肽不易合成。
为创建AMP数据集,从ADAM、CAMPR4和StarPep三个公共数据集中收集了长度为∈[11,30]的AMP
Non-AMPs
使用AmpGram创建长度为∈[11,30]的序列作为非Non-AMPs数据库。【Proteomic screening for prediction and design of antimicrobial peptides with AmpGram】
Preprocessing
去除含有非天然氨基酸的重复序列和序列
采用CD-HIT去除冗余和同源物。AMPs数据库中的样品采用CD-HIT处理,阈值为0.8。同样,为避免Non-AMPs样本中高度相似序列的过度代表,采用CD-HIT去除阈值为0.4的序列。
所有的负样本都与正样本具有等长的分布。同时为平衡数据集,删除了冗余的负样本。
Data set splitting
预处理后,最终数据集包括8268个样本(4134个AMPs和4134个Non-AMPs)。8:2分成训练集和验证集。构建额外的独立测试数据集,其中包含来自ADP3数据库的2022年新发现的162个amp和来自Sidorczuk等研究的总计111 373个Non-AMPs。测试数据集中的AMPs不包括在训练或验证集中,Non-AMPs也不包括在训练或验证集中。
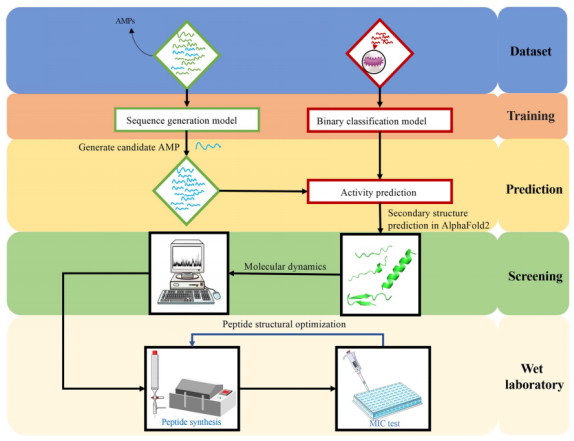
AMP generation model
利用SeqGAN来生成新的AMP:
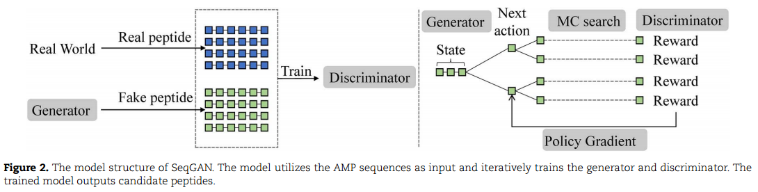
由生成器、鉴别器、蒙特卡罗(MC)搜索和策略梯度组成。利用生成器生成假肽,利用鉴别器区分真肽和假肽。我们使用MC搜索和策略梯度来训练生成器。鉴别器由真实肽和生成器生成的假肽数据进行训练。通过迭代训练,生成器产生高质量的候选肽,可以欺骗鉴别器。
AMP classification model
分类器采用ESM-2蛋白语言模型(BERT-based),该模型在Uniref数据集上预训练。特别是,在数百万个序列上学习到的特征比在中小型集合上学习到的特征对AMP的分类效果更好。然后,将BERT生成的特征表示输入到MLP模型中(训练过程中,固定BERT模型的权值,只使用AMP和非AMP数据集更新MLP权值),得到AMP和非AMP分类结果。并使用t-SNE对高维数据进行了可视化:
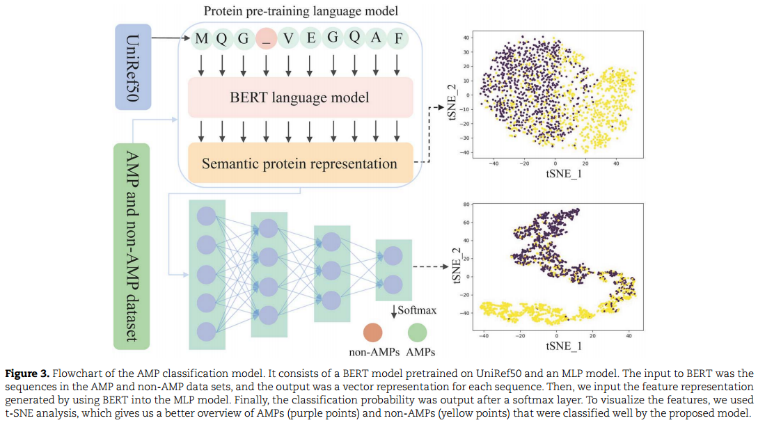
Implementation details for the AMP classification model
通过进行超参数调优来提高预测器的性能是至关重要的。该方法考虑了学习率、批处理大小和预训练模型等参数。根据AUC-ROC对超参数进行优化
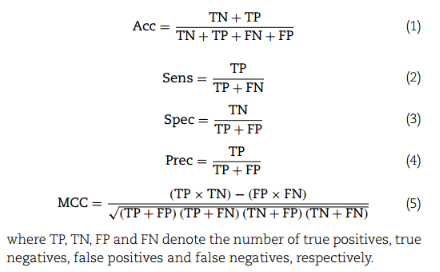
Evaluation metrics for the AMP classification model
Peptide synthesis
肽是通过固相肽合成(solid - phase peptide synthesis, SPPS)方法合成的。Rink酰胺树脂在50%二甲基甲酰胺(DMF)/50%二氯甲烷的混合溶液中反应过夜,然后加入20%哌啶溶液30分钟,去除树脂上的Fmoc保护基团。
以DMF作为氨基酸偶联溶剂,在室温(20-25℃)下,加入O-(1h -6-氯苯并三唑-1-基)-1,1,3,3-四甲基六氟磷酸脲和N,N-二异丙基乙胺,偶联1h。用三氟乙酸:三异丙基硅烷(Tips):水(90:5:5)的混合物在室温下裂解3小时。肽用冰冷的乙醚沉淀,溶解在水:乙腈(1:1)的混合物中并冻干。
粗肽在Phenomenex C18柱上用反相高效液相色谱(RP-HPLC)在214 nm处纯化,并将其放在- 20◦C下冷冻干燥保存。两个半胱氨酸的巯基用Acm保护,在浓度为1mg /mL的碘溶液中反应30min形成二硫键,最后加入抗坏血酸终止氧化反应。所有肽的分子量均采用电喷雾质谱法测定。采用反相高效液相色谱法测定肽的纯度,纯度均大于95%。
Nuclear magnetic resonance (NMR) structure determination for A-222
MD simulations
利用AMBER封装和ff14SB力场进行MD模拟,优化多肽。通过MD模拟确保了肽的结构稳定性。利用AlphaFold2生成肽的三维结构。肽在10 Å TIP3P水盒中溶剂化,用Cl-中和电学性质,并使用Bash命令运行MD模拟。采用2000步最陡下降法和3000步共轭梯度法对系统进行优化。
完成第一次能量优化后,继续进行无约束优化,然后进行MD模拟。
MD模拟包括升温过程和平衡过程。首先,在100 ps内用5 kcal mol−1·Å−2约束溶质从50 K逐渐加热到300 K,然后在100 ps内溶质结合力从5 kcal mol−1·Å−2逐渐降低到0 kcal mol−1·Å−2,然后在300 K恒温、1 atm压力下进行100 ns模拟。所有涉及的氢键均采用SHAKE算法,时间步长为2fs。MD仿真完成后,使用VMD对MD轨迹进行分析,并计算出RMSD值。
对46个多肽进行了如上所述的MD模拟。
Circular dichroism (CD) 圆二色谱,研究分子手性
在氮气气氛下,室温条件下,采用Jasco J-810型偏振光谱仪测量CD光谱,波长在250 ~ 190 nm之间,光程长度为1.0 mm,带宽为1.0 nm,响应时间为2 s,平均扫描3次。a -222溶于乙腈和水的1:1的混合物中,浓度为0.3 mg/mL。光谱用摩尔椭圆率表示。测量后,计算了摩尔椭圆度[θ]值,并根据特征峰对二级结构进行了分析。
Biological activity assay
AMPs的最低抑菌浓度(MIC)采用肉汤微量稀释法测定。检出的细菌包括枯草芽孢杆菌168、嗜麦芽窄养单胞菌w006、铜绿假单胞菌SM45、铜绿假单胞菌PAO1、苏云金芽孢杆菌BNCC 336393、金黄色葡萄球菌SYZX101、大肠杆菌ATCC 8739和产酶溶菌YC36。具体来说,在96孔板上连续加倍稀释AMPs(每孔中只剩下50 μL含有稀释AMPs的培养基)。
然后,将培养至对数相的细菌先稀释至麦克法兰标准液0.5倍,再稀释至100倍。每孔加入50 μL以上菌液后,将样品置于培养箱中16-18 h(除L. enzymatic genes YC36放置于28℃,其余放置于37℃),OD600记录数值。试验组添加顺序稀释的AMPs,对照组为纯培养基(不含菌液)和含菌液培养基,每组3平行。
三、Results and discussion
1、Estimation of training performance
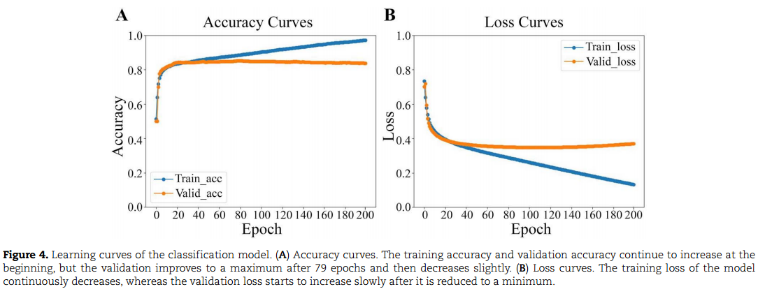
在79个epoch后已过拟合。为避免过拟合,保存了验证精度最高的模型参数。
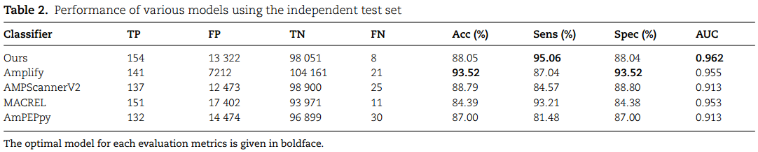
2、Comparative analysis with state-of-the-art methods
DNN-based(Amplify和AMPScannerV2)、AMP-based,如MACREL和AmPEPpy
Comparison using the validation set

Comparison using independent test set
Screening candidate AMPs
基于AlphaFold2结构预测和MD模拟,共筛选了110个肽段。在这些肽中,四个肽含有一对二硫键,而其余的不含二硫键。利用AlphaFold2预测了110个多肽的三维结构,共有97个多肽具有α-螺旋或β-链成分。通过50或100 ns MD模拟来评价α-螺旋或β链成分完整的肽的稳定性。
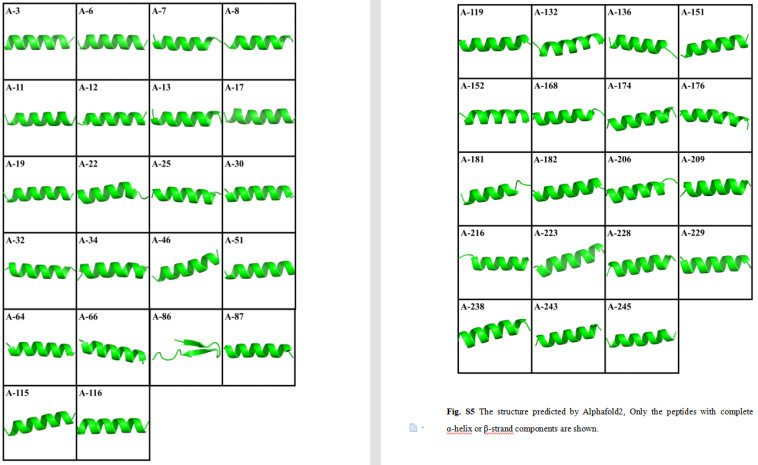
大多数肽在MD模拟中表现出高度的不稳定性,在50 ns的MD模拟后,它们的二级结构被破坏,甚至成为随机螺旋。此外,应用ESMFold模型预测肽的结构,并对AlphaFold2预测的结构进行对比分析。
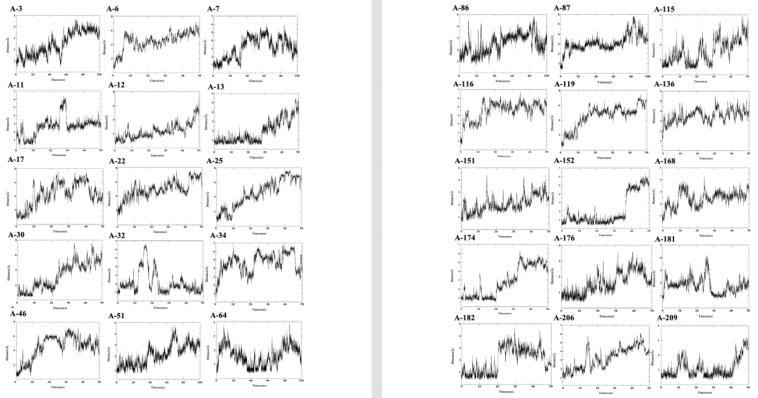
在分类器判定的110个类抗菌肽中,共有97个类抗菌肽被AlphaFold2预测为α-螺旋或β-链成分,而83个肽类抗菌肽被ESMFold预测为二级结构。然后,对AlphaFold2和ESMFold预测的结构进行了比较分析。其中82种均可获得相同的α-螺旋或β-链成分。最终选择六种能够完全或部分维持其二级结构的肽,并显示出相对较小的RMSD作为候选AMP进行湿实验室实验验证
3、Wet laboratory
Synthesis of AMP candidates
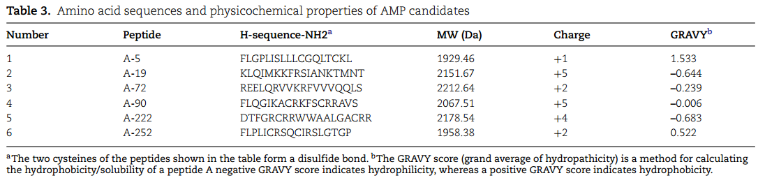
用SPPS合成候选AMP,用RPHPLC纯化候选AMP。分别用电喷雾法和反相高效液相色谱法对质量和纯度进行验证。生成AMP物化性质:
Antimicrobial activity
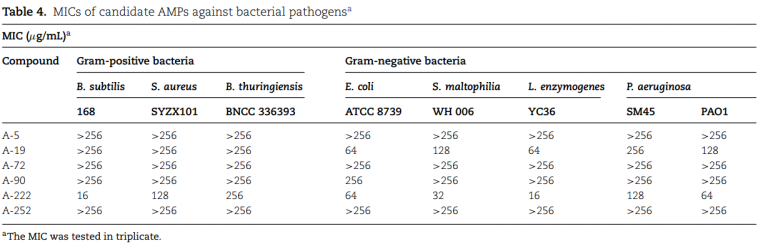
通过MIC测定了这些肽对革兰氏阳性菌株(枯草芽孢杆菌168、金黄色葡萄球菌SYZX101和苏云金芽孢杆菌BNCC 336393)和革兰氏阴性菌株(大肠杆菌ATCC 8739、酵素L. YC36、嗜麦芽葡萄球菌WH 006、铜绿假单胞菌PAO1和铜绿假单胞菌SM45)的抑菌活性。在候选抗菌肽中,A-222 (DTFGRCRRWWAALGACRR-NH2)对枯草芽孢杆菌168和酵素L. YC36的MIC值分别为16 μg/mL,对嗜麦芽葡萄球菌w006和P的MIC值分别为32和64 μg/mL。
4、Structural analyses
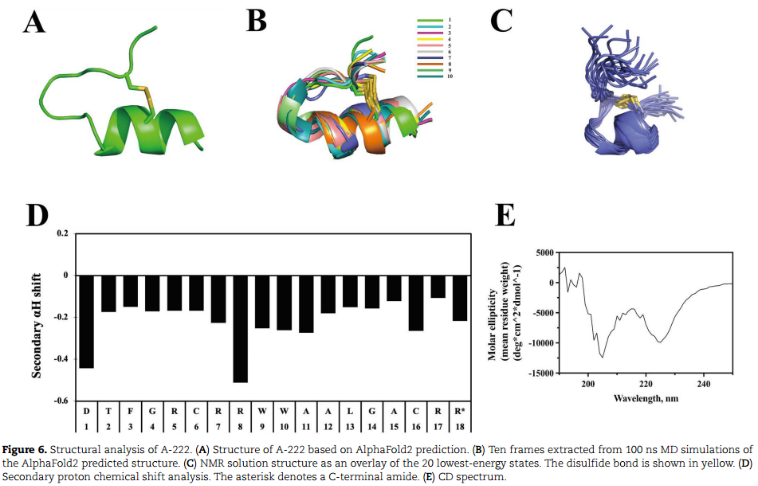
核磁共振(NMR)分析多肽和蛋白质三维结构。AlphaFold2预测其结构为带有柔性n端尾部的几圈α-螺旋结构(图6A),而从100 ns MD模拟中提取的10帧显示了该预测结构的稳定性(图6B)。此外,ESMFold预测了其结构。然后,对a -222进行核磁共振结构分析(图6C、D)。次级α质子位移分析显示,相对于随机螺旋化学位移,所有残基都呈负位移。而结构计算证实残基10-13之间存在一个小的α螺旋。根据初步结构和变温酰胺系数,在残基14和残基10的酰胺质子和羰基氧之间分别预测一个单键氢键,这进一步证明在核磁共振结构中只存在一个短螺旋。核磁共振结构与AlphaFold2预测结构的差异可能源于溶液环境的不同。
在pH为5.8的磷酸钠缓冲液中测定了其核磁共振结构,这可能影响肽的折叠。此外,还进行CD光谱分析。α-螺旋的特征峰在222和208 nm处为负,在190 nm处为正,这也证实A-222 α螺旋的存在(图6E)。因此,A-222保持了二级结构,这种稳定的结构可能与抗菌活性有关。
Design of A-222 analogs and biological activity assay