消化道不同部位有不同的菌群构成,肠道菌群与多种肠道疾病和肠外疾病(尤其代谢障碍)密切相关。肠道菌群通过产生/转化一系列代谢物和分子来影响宿主代谢健康,包括SCFA、胆汁酸、内源性大麻素、TMAO、LPS等病原相关分子模式、Amuc_1100等细菌蛋白、12-HETE等生物活性脂质,以及果糖赖氨酸和咪唑丙酸等。这些分子可作用于多种宿主细胞受体,如TLR、PPARα/γ、AhR、G蛋白偶联受体(如GPR41/43/119和TGR5)、内源性大麻素受体等,来调控宿主信号通路,影响肠腔环境、肠屏障和肠道激素分泌等生理功能。2022年,《Gut》近期发表重磅综述文章,介绍了肠道菌群对健康的作用机制,重点关注了菌群代谢产物和分子对宿主代谢健康的影响,包括一些近年来新发现的菌群分子,值得参考。

中文标题:肠道微生物组与健康:机制见解
发表时间:2022.02
发表期刊:Gut
影响因子:31.793
DOI: 10.1136/gutjnl-2021-326789
摘要
当下,肠道微生物群被认为是有助于调节宿主健康的关键性要素之一。可以知道的是,几乎我们所有的器官都定殖着微生物,这表明我们的器官之间存在不同形式和程度的相互干扰。随着分子工具和技术(即宏基因组学、代谢组学、脂质组学、宏转录组学)的发展,宿主与不同微生物之间复杂的相互作用正在逐步被破译。如今研究可知肠道微生物群与许多疾病有关,包括肥胖、2 型糖尿病、肝脂肪变性、肠道疾病 (IBD)和癌症,这说明了有关免疫、能量、脂质和葡萄糖代谢的各种反应均会受到肠道微生物群的影响。在这篇综述中,批判性评价了该领域的当下理论,讨论解释了肠道细菌是如何在分子层面上参与疾病预防或发病的许多机制。我们探究了代谢机制的终产物(即短链脂肪酸、胆汁酸、三甲胺氧化物),并扩展最近发现相关的反应分子(即内源性大麻素、生物活性脂质、酚类衍生化合物、晚期糖基化终产物和enterosynes肠合成物)及其特异性受体,例如过氧化物酶体增殖物激活受体 α (PPAR) 和 γ (PPAR)、芳烃受体 (AhR),和 G 蛋白偶联受体(即 GPR41、GPR43、GPR119、胆汁酸受体TGR5)。综上所述,探究肠道微生物与健康在分子方面的关联与复杂性将有助于为正在开发中的新型疗法奠定基础。
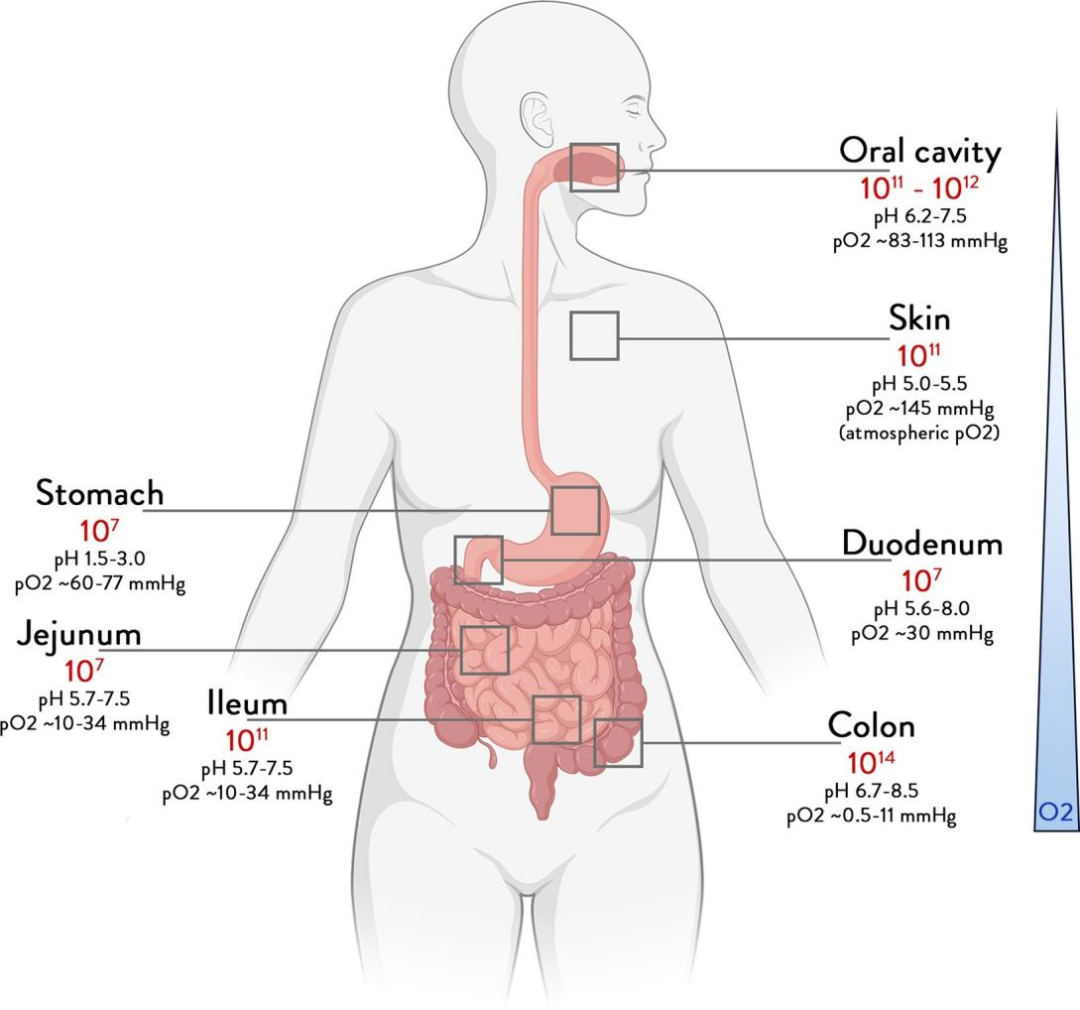
图1不同身体部位的细菌总丰度
▲THE HUMAN GUT MICROBIOME
人体肠道微生物组
人类微生物组是微生物以及它们的基因和产物的集合,它们自出现就在我们的身体中定殖并垂直转移。虽然身体所有部位都有微生物定殖(图 1),但在肠道中发现的微生物数量最多,主要是由对人类健康有影响的肠道微生物以及活性分子组成。
在健康受试者中,口腔和唾液中存在的数以百万计的微生物,在下咽的过程中,其在胃肠道中存活率受到许多因素的影响,包括胃酸度、胆汁酸(BAs)、消化酶和十二指肠及其他部位的抗菌蛋白等。还有一些主要变量会进一步影响下游微生物定殖,例如 pH、氧浓度和氧化还原电位等化学参数、产生的粘液、胆汁和抗体,以及包括肠道结构、蠕动和转运时间在内的物理方面(图1)。沿着小肠可以发现微生物数量的梯度变化,例如十二指肠抽吸物与口腔样本中的微生物拥有相似的类群组成,但丰度要低1000 倍。小肠中每克含有数千到数亿个细胞,其中耐氧的厚壁菌门和变形菌门是主要门。而下肠道微生物丰度最高,每克高达 1000 亿个细胞,因为结肠中的运输时间比小肠长十几倍,使得微生物群落最长可在肠道停留几天。结肠微生物群以厌氧菌为主,包含数千种和数百万个基因,主要分布在厚壁菌门(主要是瘤胃球菌科和毛螺菌科)、拟杆菌门、放线菌门、变形菌门和疣微菌门(阿克曼氏菌)(图1)。粪便通常被称为构成肠道微生物组的物质,它与多种疾病有关,并且可以通过饮食和药物而改变(表 1)。粪菌移植 (FMT) 已经证明可以治愈复发性梭菌感染和其他疾病。
表1 PubMed中 关于“微生物组与疾病”主题文章

人可以没有结肠但不能没有小肠,在我们身体中小肠具有最大的粘膜表面,食物会在小肠中进一步消化和吸收。小肠含有大部分肠道受体、免疫细胞和神经细胞,并且是越来越多地隐含在基本的微生物-宿主串扰中。虽然很难进行试验研究,但近年来已经开发了各种新技术,其中包括用于采样、输送或检查的导管或胶囊。此外,相关研究发现通过回肠造口术取得的小肠流出物每克湿重含有多达 1 亿个微生物,形成了特定群落,这可以反映食物摄入和消化规律(转录组学和靶向代谢组学),宏基因组学对此类样品的分析表明,定殖的链球菌和乳杆菌属与宿主竞争多糖的消化,产生乳酸和乙酸盐,然后转化为丙酸盐。导管实验证实了特定群落,并揭示了十二指肠与空肠相比,微生物群的组成表现出 pH 值显著相关,空肠是具有最大表面肠道隔室的肠道,负责大部分糖、蛋白质和脂质的消化和吸收。十二指肠和空肠之间是一个连续体,而靠近末端的的回肠有一个大的粘液层,上面定植了一些厌氧菌,包括拟杆菌、瘤胃球菌科和毛螺菌科,其中一些也参与在 BAs 中转化(参见生物活性脂质/胆汁酸部分)。
十二指肠及其微生物已成为各种代谢疾病和免疫疾病的主要来源,如十二指肠的 FMT 可以缓解代谢综合征或自身免疫性疾病的症状。此外,已发现对活体十二指肠灌注乳酸杆菌或死乳酸杆菌会影响宿主免疫反应,这为我们提供了一个实验方法。该方法最近被用于分析单一剂量的十二指肠厌氧菌 Anaerobutyricum soehngenii(以前称为 Eubacterium hallii),其使十二指肠再生胰岛蛋白1B的基因表达水平增加近10倍,还使代谢综合征受试者的血清胰高血糖素样肽E-1(GLP-1)和次级胆汁盐增加,这可能潜在的说明了它对糖尿病的改善。
在结肠中进行的研究表明,肠道微生物存在明显的垂直梯度,但也存在水平梯度。重要的是,存在氧气、氧化还原和粘液梯度,这些梯度始于粘膜表面并延伸至管腔,形成特定的微生物群落的结构。广义地说,这些菌群以黏液降解菌群开始,通常以黏液溶解和微需氧的嗜粘菌阿克曼氏菌(Akkermansia muciniphila)为主,以严格的厌氧菌群结束,包括产生丁酸盐和产生丙酸的瘤胃球菌科、毛螺菌科和拟杆菌,以及分别将氢和二氧化碳转化为乙酸或甲烷的同生乙酸菌和产甲烷菌。
▲THE GUT MICROBIOME AND VARIOUS INTESTINAL AND EXTRAINTESTINAL DISEASES
肠道微生物群群落与各种肠道和肠道外疾病
肠道微生物组与多种肠道和肠外疾病有关。许多关于肠道微生物群及其相关性的大型研究已经在特定的胃肠道(GI)疾病中进行,例如肠道肠病 (IBD)、乳糜泻、肠易激综合征 (IBS)、结直肠癌 (CRC)、慢性肝病或胰腺癌障碍。IBDs 是肠道的典型炎症性疾病,与肠道微生物群组成改变有关,而且有报道称称会出现兼性厌氧菌过度生长,尤其是在有活动性炎症和代谢紊乱的情况下,包括 BA、短链脂肪酸 (SCFA) 和酰基肉碱途径。对有乳糜泻(另一种常见的炎症性肠道疾病)风险的婴儿进行纵向分析,发现在疾病发作前,几种微生物种类的存在增加,如Dialister invisus,副杆菌属(Parabacteroides spp)或乳酸菌科(Lachnospiraceae)和某些代谢物增加(如色氨酸代谢物),而各种抗炎菌株,如粪便杆菌(Faecalibacterium prausnitzii)或梭状芽孢杆菌(Clostridium clostridioforme)则有所减少。IBS是一种常见的胃肠道功能性疾病,与肠道微生态系统和相关代谢产物中IBS亚型特异性变化有关,尤其是嘌呤代谢受到影响。CRC 是下肠道最常见的恶性肿瘤,与肠道微生物群紊乱相关,并与某些细菌如具核梭杆菌、大肠杆菌或脆弱拟杆菌有关,其中一些来自口腔微生物群。慢性肝病,尤其是肝硬化等晚期肝病,其特点是微生物严重畸变,益生元、益生菌和抗生素干预研究的数据已充分证明肠道微生物群在这些疾病中起着关键作用。恶性肿瘤胰腺腺癌也与肠道微生物组受损有关,因为肿瘤内微生物组的组成会影响宿主免疫反应和疾病的自然病程。
过去几年,肠道微生物群在肥胖和肥胖相关疾病中得到了广泛研究,如2型糖尿病(T2D)和非酒精性脂肪肝(NAFLD)。许多研究尝试将肠道微生物组的改变与肥胖相关联,事实上,对某些细菌菌株(如粘液阿克曼菌)的干预性研究表明,对肥胖相关参数有影响。在亚洲和欧洲人群中,T2D还表现为肠道微生物群受损。在T2D中,微生物变化与胰岛素抵抗的存在密切相关,多项研究表明肠道微生物组影响葡萄糖调节。NAFLD是目前西方世界最常见的慢性肝病,被认为是肥胖、代谢综合征和T2D交界处的一种原型代谢障碍。越来越多的证据表明,肠道微生物组-肝轴在 NAFLD 中发挥作用,特别是在纤维化和向更晚期疾病阶段进展的情况下,例如非酒精性肝脂肪变性。几项研究现已证明,非酒精性脂肪肝的特征是某些肠杆菌科细菌、大肠杆菌大量繁殖,而F.prausnitzii数量减少。最近的数据还表明,在NAFLD中,微生物组群的偏差和不稳定性可能存在多年,甚至可能先于NAFLD和T2D的发展。越来越多的胃肠道和代谢疾病研究在肠道微生物群中进行。(概述见表1)。
▲GUT MICROBES AND METABOLIC DISORDERS: MOLECULAR ACTORS
肠道微生物和代谢紊乱:分子因素
肠道细菌群落在代谢紊乱的多方面调节中起着重要作用。除其他外,这种调节取决于微生物群产生的各种代谢物,以及它们与宿主细胞上受体的相互作用,这些受体可以激活或抑制信号通路,对宿主健康有益或有害(图 2)。
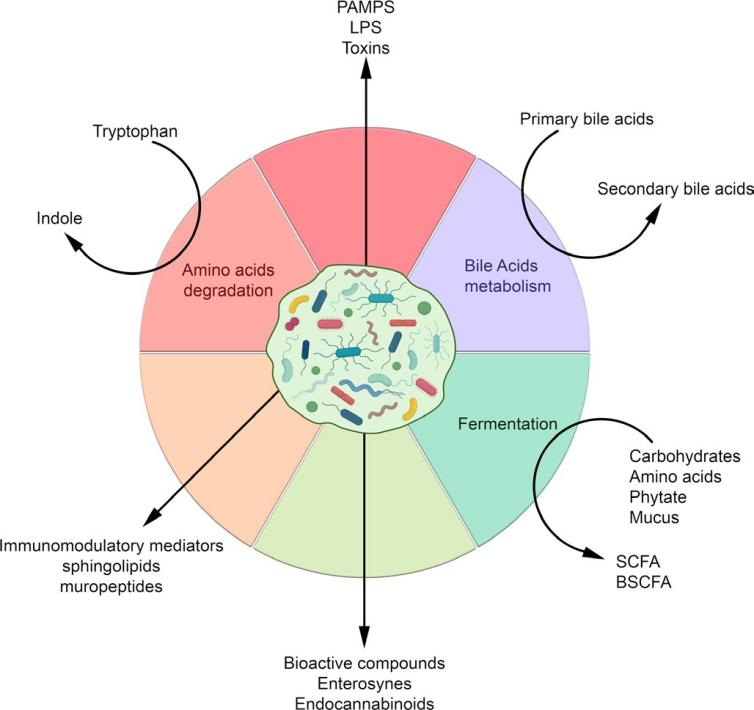
图2 肠道微生物群根据营养物质或代谢来源及其衍生化合物产生的分子和代谢物。BSCFA,分支SCFA;LPS,脂多糖;PAMPs,病原体相关分子模式;SCFA,短链脂肪酸
参与这些相互作用的细菌代谢物种类繁多,从小分子到大分子不等。它们包括细菌代谢的副产物,例如 SCFA,以及细菌完整性所必需的复杂大分子,例如肽聚糖和脂多糖 (LPS)(图 2)。这些代谢物的丰度和可用性取决于微生物组成,因此受饮食和环境因素的调节。下面讨论主要的分子因素。
▲Short chain fatty acids and impact on host health: molecular mechanisms
短链脂肪酸及其对宿主健康的影响:分子机制
小肠是专门负责营养物质的分解、乳化和吸收的,少量营养物质不被消化。例如,在正常情况下,<5 g/天的脂肪会到达结肠。同样的原理也适用于简单碳水化合物(分解为糖分子)和大多数蛋白质(转化为氨基酸)的消化和吸收,尽管由于摄入量的不同,可能一些蛋白质会到达结肠。相反,复杂的碳水化合物是不可消化的,如膳食纤维,身体缺乏必要的酶来消化它们,从而使它们无法在小肠中消化。然而,在结肠中它们可以被特定的常驻细菌用作能量来源。肠道微生物将有助于不易消化的碳水化合物代谢成不同的 SCFA 分子(例如,乙酸盐、丁酸盐和丙酸盐)。短链脂肪酸具有良好的化学特性,它们对健康的影响已被广泛记录。
这些化合物可以调节肠道和许多代谢途径,例如肝脏、脂肪组织、肌肉和大脑(图 3)。如今,已知这些微生物代谢物有助于调节能量稳态、葡萄糖/脂质代谢、炎症甚至免疫和癌症等。

图3在健康和病理情况下连接肠道微生物群和宿主健康的分子机制
在健康情况下,结肠细胞通过线粒体中的β-氧化使用丁酸盐作为能量底物,从而消耗氧气并直接有助于维持腔内的厌氧状态。丁酸盐还与过氧化物酶体增殖物激活受体γ(PPARγ)结合,抑制诱导一氧化氮合酶(iNOS),减少一氧化氮的产生(NO)并最终减少硝酸盐的产生。相反,在病理情况下,管腔中的低丁酸盐含量与较低的PPAR活性,增加糖酵解和降低氧气消耗。这与iNOS的更高表达相关,其反过来产生更多的NO并最终使用增加特定病原体的硝酸盐。丁酸盐还可以刺激免疫细胞如调节性T细胞(Treg)以减少炎症。核转录因子芳烃受体(AhR)在健康结肠细胞中高度表达和活化,而AhR的激活剂较低或AhR活性降低可导致肠屏障功能改变。肠内分泌细胞(L-细胞)表达由短链脂肪酸(SCFA),特异性内源性大麻素(eCB)和胆汁酸(BA)激活的几种关键受体。激活这些受体增加关键肠肽如胰高血糖素样肽(GLP-1,GLP-2和PYY的分泌)。总之,肠道微生物与这些分子参与者之间的相互作用有助于降低肠道通透性,改善胰岛素分泌和胰岛素敏感性,减少食物摄入,降低血浆脂质并避免肝脏脂肪变性和代谢性内毒素血症。所有这些影响都与较低的炎症有关,在病理情况下观察到相反的效果。
通过一系列的实验研究,已经发现了富含可发酵膳食纤维(例如益生元)的饮食能够在抑制体重增加、脂肪量、抗胰岛素和能量摄入的许多分子机制起到作用。其中,发现使用益生元调节肠道微生物群导致 L 细胞产生的几种肠道肽(如 GLP-1、GLP-2 和PYY)(图 3)。这些不仅影响一种类型的可发酵碳水化合物,因为抗性淀粉或阿拉伯木聚糖的微生物发酵成 SCFA 会产生与血浆 GLP-1 和 PYY 增加相关的类似生理学影响。然而,可发酵纤维的化学结构与 SCFA 产量直接相关,因为生成的丁酸盐、乙酸盐或丙酸盐的数量取决于纤维的类型。例如,菊粉被认为是丙酸产物,而抗性淀粉则更多的是丁酸。同时,一些结肠细菌也通过替代途径从赖氨酸等氨基酸生产丁酸盐,或从植酸盐等植物化合物生产丙酸盐。值得注意的是,SCFAs来源于饮食,他们可以从宿主本身通过发酵肠粘液覆盖在肠道上皮细胞。
SCFAs 通过作用于在回肠末端和结肠中特别丰富的肠内分泌 L 细胞表面表达的特定 G 蛋白偶联受体来刺激肠道肽的分泌。这些受体,命名为 G 蛋白偶联受体 GPR43(或游离脂肪酸受体 2 (FFAR2))和 GPR41(或 FFAR3)(图 4),会在多种组织和细胞类型中表达(例如,脂肪细胞、免疫细胞)。通过使用缺乏 GPR43 或 GPR41 的小鼠模型,已经阐明了微生物组对肠道肽分泌的关键作用。缺乏这些受体的小鼠在接触 SCFA 或特定益生元后表现出 GLP-1 和 PYY 分泌减少(图 3)。
除了众所周知的作用和作用机制外,一些 SCFA 还可能发挥与以前认知不同的功能。例如,丁酸盐被多次证明是结肠细胞增殖和维持肠道屏障的必需能量来源。最近的研究表明,丁酸盐还通过与结肠细胞影响微生物环境。事实上,厌氧细菌保持在上皮附近的关键要求是肠腔部分及其上皮的的氧含量浓度逐渐降低,而肠杆菌科(肠杆菌门)等兼性厌氧菌被证明会增加肠道炎症的风险(图3)。丁酸盐通过激活线粒体中的β-氧化,有助于控制结肠中的厌氧状态。通过激活结肠细胞中的核受体过氧化物酶增殖物激活受体 γ (PPARγ),丁酸盐限制了氧气从结肠细胞向管腔部分的扩散,从而维持了厌氧条件。PPARγ 的激活还抑制了编码一氧化氮合酶的基因的表达,从而降低了 NO 的产生并最终降低了腔内硝酸盐的水平,而腔内硝酸盐是用于假定致病性兼性厌氧菌(肠杆菌科)增殖的特定能源(图 3)。在患有严重肠道炎症的人类身上也观察到了类似的现象,例如在 IBD、癌症、肥胖和糖尿病期间,已检测到肠杆菌科的丰度增加。
许多论文都指出,所有这些疾病也与产生SCFA(主要是丙酸盐和丁酸盐)的细菌数量减少有关。例如,细菌 F. prausnitzii、A. muciniphila 和 Dysosmobacter welbionis。在乙酸盐存在下,Anaerostipes 和 Anaerobutyricum spp 通过乙酰辅酶 A 途径从乳酸生成丁酸。这些可以在小肠以及结肠中形成营养链,各种细菌在结肠中产生乳酸。乳酸在肠道环境中的积累会导致胃肠道疾病,这可能解释了代谢综合征受试者使用丁酸 A. soehngenii 进行干预治疗的一些行为。
除了丙酸盐和丁酸盐,琥珀酸盐的影响也在研究中。琥珀酸盐是三羧酸循环的中间体,被认为是线粒体氧化磷酸化的底物,也是细菌的代谢产物。在这个观念下,琥珀酸一直被忽略,因为它被认为是丙酸合成的主要中间体。目前,琥珀酸盐的作用在很大程度上仍然存在争议,因为有报道称琥珀酸盐与胰岛素抵抗、肥胖和炎症之间既有有益也有有害的关联。
▲Lipopolyscaccharides/Pathogen-associated molecular patterns
脂多糖/病原体相关分子模式
肠道屏障是一个复杂而动态的物理和化学结构集合,它可以监视环境,保护宿主免受微生物入侵和有害刺激。其中一些来自环境的有害成分是所谓的病原体相关分子模式(PAMP),细菌LPS是其中的典型类别。LPS 是在革兰氏阴性菌细胞膜上发现的内毒素,是炎症反应的有效激活剂,即使向循环中释放少量 LPS 也足以引发炎症反应。LPS 和其他 PAMP 通过激活特定的模式识别受体 (PRR) 发挥其活性,这些受体感知微生物和感染因子并发出防御反应的信号。PRR 有四个主要亚家族:tol 样受体 (TLR)、核苷酸结合寡聚化结构域-富含亮氨酸重复序列 (LRR) 的受体、视黄酸诱导基因 1 (RIG-1) 样受体(又名 RIG-1 样解旋酶)和 C 型凝集素受体。在这些受体中,人类中TLRs受体家族成员有10个(小鼠13个),其特征最为明显。每种TLR都能介导对来自病原体的不同微生物成分的反应。两个典型的例子是TLR2-感知细菌脂蛋白,TLR4-识别细菌LPS。TLR 涵盖了广泛的外部刺激 (PAMP) 和源自组织损伤的内部信号(损伤相关分子模式 (DAMP))(图 3 和图 4)。这些配体有多种形式和大小:从核酸到脂质,从小化合物到大分子。TLR 广泛分布于免疫细胞中,包括巨噬细胞、中性粒细胞、树突状细胞、自然杀伤细胞、肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞,但也存在于其他身体细胞中,例如肠上皮细胞。它们的激活诱导抗原呈递细胞的激活,从而架起先天性和适应性免疫反应的桥梁,并刺激信号级联反应,以抵御微生物入侵或修复受损组织。虽然这种炎症反应是消除感染所必需的,但 TLR 的过度激活会导致免疫稳态的破坏,持续的促炎细胞因子和趋化因子的产生会增加炎症性疾病和自身免疫性疾病的风险。代谢性内毒素血症就是这种情况,其中高脂肪饮食和体重增加与更高的肠道通透性和随后循环血浆 LPS 的全身(轻度)升高有关,在这种情况下,高脂饮食和体重增加与更高的肠道通透性和随后循环血浆LPS的全身升高(轻度)有关。这会导致低度炎症状态,这是一系列慢性疾病的病理特征,包括T2D、NAFLD、慢性肾病和动脉粥样硬化。有趣的是,不同类型细菌的LPS对肠道屏障功能、脂肪炎症、肠道葡萄糖吸收、血糖、胰岛素和肠促胰岛素有不同的影响,这表明代谢性内毒素血症水平对宿主代谢的影响可能因肠道菌群组成和功能而异。
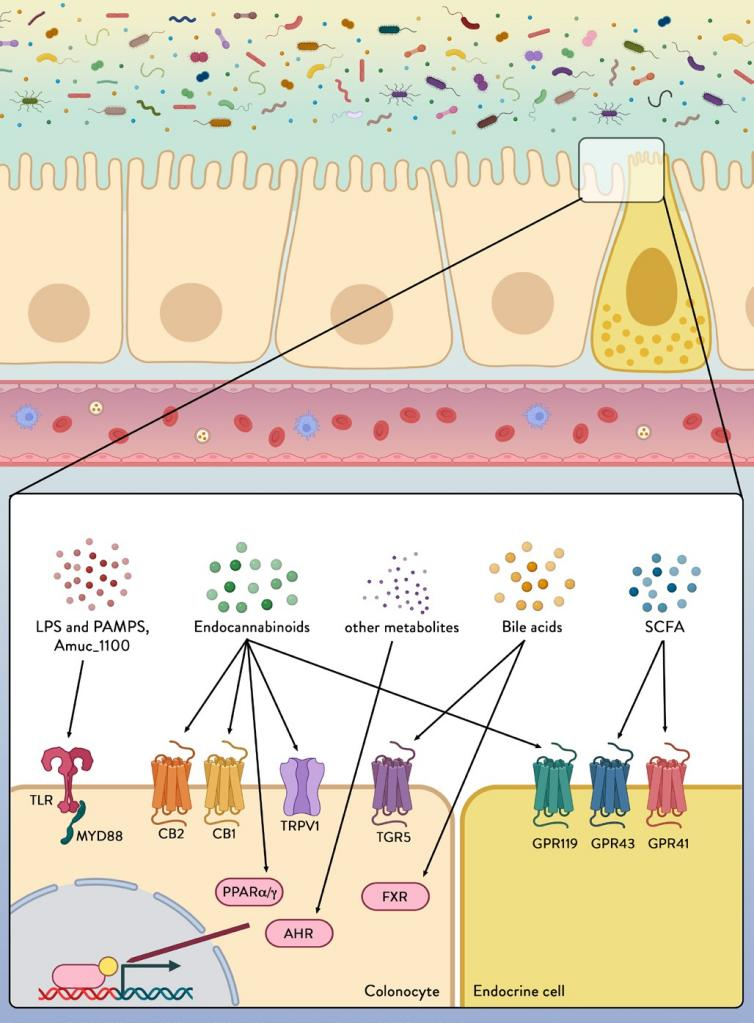
图4结肠细胞和内分泌细胞表达多种能够感知和传递来自微生物环境的信号的受体
通过模式识别受体(TLR)检测来自微生物群的微生物/病原体相关分子模式(PAMP),脂多糖(LPS)。Amuc_1100是一种在Akkermansia muciniphila外膜上表达的蛋白质,已被证明可通过TLR2发出信号,改善肠道屏障功能并减少炎症。
由微生物消化膳食组分(例如短链脂肪酸(SCFA))或通过转化宿主衍生因子(例如eCB和胆汁酸)产生的某些微生物(例如内源性大麻素(eCB))分泌的代谢物可以是通过各种受体和途径感知,以改变肠道完整性和宿主健康。CB1,CB2,大麻素受体1型和2型;TRPV1,瞬时受体电位阳离子通道亚家族V成员1;FXR,法尼醇X受体;AhR,芳烃受体;GPR119,GPR43,GPR41,G蛋白偶联受体119,43和41;MYD88,髓样分化初级因子88;PPARα和PPARγ在炎症反应中起重要作用,过氧化物酶体增殖物激活受体α和γ;TGR5,胆汁酸受体TGR5。PRRs 表达的中断与有利于炎症的微生物群组成的变化有关。例如,小鼠缺乏由细菌鞭毛蛋白激活的 TLR5 会发展为结肠炎或代谢综合征,这与微生物群的改变有关。已显示下游信号通路的 TLR 激活依赖于骨髓分化因子 88 蛋白 (MyD88)(图 4)。MyD88 是所有 TLR 的必需衔接蛋白,除了 TLR3 和肠道中 MyD88 的缺失部分保护免受饮食引起的肥胖、糖尿病和炎症,并增加抗炎内源性大麻素 (eCBs),恢复抗菌肽的产生并增加肠道调节性 T 细胞。
尽管在我们充分了解 PAMS/DAMPS、PRR、微生物组和疾病如何相互作用之前仍有许多问题有待回答,但我们对这种复杂相互作用的日益了解正在为炎症依赖性疾病开辟新的治疗可能性。
▲Bioactive lipids
生物活性脂质
●Endocannabinoid system
内源性大麻素系统
在过去的二十年里,eCB 系统因其广泛的生理效应而被广泛探索。在其多效性作用中,eCB 信号系统似乎在调节能量、葡萄糖和脂质代谢方面发挥关键作用,而且在免疫、炎症以及最近的微生物群-宿主相互作用中也发挥着关键作用。
从历史上看,在 1988 年确定了第一个内源性大麻素受体-内源性大麻素受体 1 型 (CB1) ,是大麻的神经性化合物 Δ9-四氢大麻酚激活剂,随后在 1993 年发现了第二种受体,大麻素受体 2 型(CB2)。两种受体都是 GPR,并具有共同的信号传导机制。第一个确定的内源性激活剂是anandamide(N-花生四烯酰乙醇酰胺(AEA))。AEA是属于N-酰基乙醇胺(NAE)家族的一大类生物活性脂质的关键成员之一。第二个关键配体是2-花生四烯酸甘油(2-AG)。自从发现这两种主要化合物以来,eCB 家族已经扩大,不再局限于仅对 CB1 和 CB2 受体具有特定活性的 eCB。例如,一些 eCB 还与 PPARα 和 PPARγ 以及其他膜受体如 GPR55 或瞬时受体电位 TRPV1 相互作用(图 4)。除了所谓的“真正的”eCB,即能够结合CB1和CB2的eCB外,许多与eCB结构相似的其他化合物已被证明在不直接激活CB1或CB2 eCB受体的情况下干扰eCB反应。所有这些分子都被称为生物活性脂质 eCB 化合物或同系物,包括其他 NAE 或酰基甘油家族的成员。然而,eCB 类化合物也可以发挥其自身的药理活性,例如,N-油酰乙醇胺 (OEA) 或 N-棕榈酰乙醇胺 (PEA) 可以激活 PPARα 和 TRPV1,而 OEA、N-亚油酰乙醇胺 (LEA) 和 2-油酰甘油 (2-OG) 能够激活 GPR119。结果表明,1-棕榈酰甘油 (1-PG) 和 2-棕榈酰甘油 (2-PG) 都是 PPARα激活剂(图 4)。2010年发现,在参与调节肠道屏障功能的代谢系统中,eCB系统发挥着重要作用。首先发现肠道 eCB 系统在肥胖和糖尿病期间发生改变,AEA 的丰度增加,通过 CB 依赖性机制触发肠道通透性。有趣的是,这种对 eCB 系统信号的变化与肠道微生物群的变化有关。此外,使用有效的 eCB 兴奋剂对 eCB 系统进行药理学激活,增加脂肪生成并破坏肠道屏障。肠道菌群、脂肪组织代谢和 eCB 系统之间的关联已得到证实,因为遗传肥胖和糖尿病小鼠(ob/ob 和 db/db)的肠道菌群组成都发生了显著变化。这与改变的全身组织代谢和 eCB 系统信号有关。总之,这些数据证明 eCB 系统的特定生物活性脂质与肠道微生物群、脂肪组织的发育和肠道功能之间的联系。
为了进一步探索潜在机制并证明这些 NAE 的合成是否可能与代谢紊乱的发作和肠道微生物群的变化有关,已经建立了几种小鼠模型,其中 N-酰基磷脂酰乙醇胺水解特异性磷脂酶 D (NAPE-PLD) 是一种关键的合成酶,在脂肪细胞、肠上皮细胞或肝细胞中均已失活。
脂肪细胞中缺乏 NAPE-PLD 的小鼠在正常热量饮食中自发地发展为肥胖、胰岛素抵抗和炎症,并且对高脂肪饮食诱导的代谢紊乱更敏感。NAPE-PLD 的脂肪细胞特异性缺失降低了脂肪组织中的产热过程(即褐变/褐变),并导致肠道微生物群组成发生显著变化。此外,将缺失 NAPE-PLD 小鼠的脂肪组织微生物群转移到无菌受体小鼠整体表型不变,表明存在与肠道微生物群的因果作用。当在肠上皮细胞中缺失 NAPE-PLD 时,会出现不同的表型。小鼠在第一次进行高脂肪饮食后变得过度进食,然后发展为饮食诱导的肥胖和肝脂肪变性。从机制上讲,这归因于肠-脑轴的缺陷,下丘脑 Pomc 神经元的改变,可以通过肠道和血浆 eCB 的变化解释。值得关注的是,肠道微生物群在该模型中也受到影响,调节微生物群可以部分恢复表型。在最后一个模型中,肝细胞中 NAPE-PLD 缺失的小鼠在正常饮食(即脂肪量增加、肝脏脂肪变性、肝脏炎症)下发展出类似高脂肪饮食的表型。这些影响与已知受肠道微生物群影响的其他关键生物活性脂质的变化有关,例如 BA。总的来说,所有这些数据和动物模型表明,eCB 系统通过 NAPE-PLD 正在通过产生生物活性脂质与肠道微生物群产生作用,并且这种酶的任何失调都可能导致代谢并发症。
为了进一步探索肠道微生物群与 eCB 系统调节之间的潜在联系,我们在不同时间点将无菌小鼠的内源性大麻素组 (eCBome) 与常规小鼠的内源性大麻素组 (eCBome) 进行了比较。eCBome 是 eCB 系统的扩展,包含超过 50 种受体和代谢酶,以及超过 20 种具有重要功能的脂质介质。发现肠道 eCBome 基因表达和脂质介质水平的均具有年龄依赖性。粪便移植从同年龄段对照小鼠供体到无菌小鼠,仅在 1 周后就逆转了其中的一些变化。总之,研究表明肠道微生物群直接影响宿主 eCBome。
研究证明,宿主的 eCB 系统和肠道微生物群之间存在双向交互作用,需要进一步研究以解开这种关系的剩余问题。更复杂的是,最近表明肠道微生物群本身能够产生特定的 eCB。这为探索微生物群与宿主相互作用开辟了新的机会,并提供了几个新猜测的治疗靶点。
● Bile acids
胆汁酸
初级胆汁酸(BA),例如人类的胆酸 (CA) 和鹅去氧胆酸 (CDCA)(以及啮齿动物的鼠胆酸 (MCA)),是在肝脏中由胆固醇合成的两亲分子。它们可以在分泌到胆汁中并储存在胆囊中之前与甘氨酸或牛磺酸结合。当摄入食物时,BAs 会释放到小肠中,帮助消化和吸收膳食脂肪。大约 95% 的肠道 BA 在回肠中被重新吸收,然后返回肝脏重新分泌。BAs 的这种肠肝循环每天发生数次,是维持全身葡萄糖、脂质和能量稳态以防止高血糖、血脂异常和肥胖的重要生理机制,它可以预防消化系统和心血管系统的炎症性代谢疾病。一小部分 BA 会逃离这个高效循环并到达结肠。然后这些 BA 要么被重新吸收到循环中,要么通过粪便排出。损失的 BAs 会通过肝脏合成进行补偿,肝脏合成受小肠信号传导中的成纤维细胞生长因子 19 (FGF19)(啮齿动物中的 FGF15)调节。
尽管 BAs 的主要功能是调节胆固醇、甘油三酯和脂溶性维生素的消化和吸收,但最近发现,BAs 还具有内分泌功能可以充当信号分子。此外,BAs 已被证明通过激活几种受体来调节上皮细胞增殖、基因表达,脂质、葡萄糖和能量代谢。这些受体是维生素 D 受体、孕烷 X 受体、组成型雄烷受体、法尼醇 X 受体和 G 蛋白偶联胆汁酸受体 1(也称为 G 蛋白偶联受体 5 (TGR5))(图 4 )。这些受体存在于许多组织中,包括肝脏、肠道、肌肉、脂肪以及中枢和外周神经系统,并介导信号级联反应并激活参与 BA、脂质和碳水化合物代谢及能量消耗和炎症的基因的表达。通过 FXR 和 TGR5 受体的信号传导也与 PYY 和 GLP-1 等 GI 激素的分泌有关(图 3 和 4),已知这些激素对于维持能量和代谢稳态是不可或缺的。BAs 在控制葡萄糖、脂质和能量代谢中的作用不再赘述。
初级 BA 易受肠道微生物的改变。这些改变包括通过胆盐水解酶 (BSH) 活性的去解离(去除氨基酸残基)和通过去除羟基(脱羟基)、氧化(脱氢)或差向异构化的进一步代谢。这导致形成次级 BA,例如脱氧胆酸、石胆酸和熊去氧胆酸。这种细菌代谢改变了 BA 的生物利用度和生物活性,从而改变了它们对参与的代谢反应的影响。根据微生物信号传导能力以及 BA 被肠道微生物群化学转化,可以考虑 BA作为微生物群衍生的信号代谢物。这是一种时空模式, BA 在食物摄入后释放,然后在肠道中遇到不同的微生物群落。虽然BSH活性可由分布在许多系统发育不同细菌分区中的多种细菌进行,包括能够在小肠定殖的物种,但其他反应被认为更局限于肠道远端的更专业的细菌物种。因此,要充分了解肠道微生物群对宿主代谢的作用,研究能够转化 BA 的不同细菌的参与是必不可少的。最近一项针对百岁老人的研究表明,他们特定的肠道微生物群可以产生独特的二级 BA ,这种特征可能可以部分解释他们对衰老相关疾病、慢性炎症和传染病的易感性的降低缘由。这意味着通过调节肠道微生物群组成来操纵 BA 池可能代表一种对抗疾病的可行方法。
●Aryl hydrocarbon receptor: a link to energy metabolism, inflammation and gut microbiome
芳烃受体:与能量代谢、炎症和肠道微生物群的联系
在脊椎动物细胞中芳烃受体 (AhR) 普遍表达,该转录因子在与配体结合后被激活。有许多 AhR 配体存在,包括环境触发因素、营养衍生信号、各种植物化学物质和细菌代谢物,如色氨酸(图 2)。AhR 配体结合导致 AhR 易位进入细胞核,在那里它与其二聚化分子 AhR 核转运蛋白结合,导致出现许多参与免疫和炎症过程的基因转录(图 3)。细菌产物和代谢物作为激活剂发挥着关键作用,前几年试图弄清楚 AhR 与肠道微生物群的相互作用(图 3 和 4)。重要的是,这种 AhR 途径也与能量代谢和代谢综合征有关,在临床前和临床中在代谢综合征中,将色氨酸代谢为 AhR 结合衍生物的能力会降低。
这些作者表明,增加AhR 配体实现了通过施用乳酸杆菌菌株可改善代谢功能,同时改善肠道屏障并减少肝脂肪变性。Indigo 是一种天然存在的 AhR 配体,具有强效抗炎活性,可通过上调乳杆菌属和关键屏障细胞因子白细胞介素 (IL)-10 和 IL-22 来防止高脂饮食引起的肥胖和代谢紊乱。微生物色氨酸代谢物(如吲哚-3-乙醇、吲哚-3-丙酮酸和吲哚-3-醛)通过影响包括肌球蛋白IIA和ezrin在内的复合体的完整性来保护肠道上皮屏障。在酒精性肝病(一种肠道微生物群严重受损的疾病)中,诱导AhR配体和给予6-甲酰吲哚(3,2-b)咔唑(Ficz)改善酒精性肝病。半胱天冬酶招募的9−/− 小鼠更易患结肠炎,其微生物群无法将色氨酸代谢为其各自的代谢物。将这种微生物群转移到野生型小鼠中会增加结肠炎几率,可以通过提供大量 AhR 配体的乳酸杆菌进行治疗来改善。AhR 通路也可能对其他炎症性胃肠道疾病(如乳糜泻)具有重要意义。与非乳糜泻对照受试者相比,患有活动性乳糜泻的患者肠道中的 AhR 配体产生减少,此外在表达 DQ8(仅携带人类 MHC II 类 DQ8 的转基因小鼠)的非肥胖糖尿病小鼠中,进行高色氨酸饮食,用罗伊氏乳杆菌(一种产生大量 AhR 配体的细菌菌株)治疗或用 AhR 配体 Ficz 治疗可减少谷蛋白暴露后的肠道病变。无菌小鼠表现出表皮屏障的分化和修复的功能受损,而在角质形成中缺乏 AhR 细胞的小鼠对皮肤感染和屏障损伤出现高度敏感,通过特定细菌群的定植恢复了屏障。在这个模型中,肠道细菌可能在推定的肠-皮轴中发挥的作用仍有待确定。因此,AhR 通路可以反映微生物群-上皮屏障-代谢和免疫功能的原始通路。
●Key bacteria and their specific molecules
关键细菌及其特定分子
大多数信号代谢物可以由大量不同的肠道细菌产生,因此特异性有限。但是各种细菌可以产生与宿主具有独特相互作用的特定分子(图 2-4)。这些已经在能够产生特定毒素的致病基因中得到了很好的表征,这些病原体可以制造特定的毒素、合成多糖以逃避免疫系统或诱导宿主合成受体,从而允许它们入侵。最近的研究已经确定了在潜在共生肠道细菌中发现的新的宿主信号分子,这些包括由拟杆菌属产生的免疫调节多糖和鞘脂,以及由肠球菌属形成的鼠肽。
特定分子是由同一物种的一个或几个菌株遗传编码的蛋白质,有些已被详细研究,通常涉及维稳或翻译后修饰的蛋白质,这些蛋白质在位于细胞包膜或分泌时有可能与宿主受体产生相互作用。其中一些来源于已作益生菌标记的细菌,包括嗜酸乳杆菌 NCFM,它会产生一个糖基化的表层蛋白强烈信号传导至 DC-SIGN 受体,即鼠李糖乳杆菌 GG 的长度是 90 kDa 菌毛蛋白 SpaC,它是一种部分糖基化的粘液结合蛋白,对树突状细胞上的 DC-SIGN 受体和一些双歧杆菌属中发现的菌毛位点 Tad 蛋白具有不同寻常的信号传导能力,可促进结肠持久性和上皮增殖。最近研究的大肠杆菌的酪蛋白分解蛋白酶 B (ClpB),它是 α-黑素细胞刺激激素的类抗原,可以通过血浆产生 GLP-1 和 PYY 来增加饱腹感。ClpB 蛋白是众所周知的兼职蛋白,由多种细菌分泌包括乳酸杆菌和双歧杆菌。然而,在一定程度上特异性以及抑制饱腹感方面,ClpB 可能不如在人体试验中的哈夫尼亚菌中产生 ClpB 的那么高。
考虑到未杀菌和巴氏杀菌的嗜粘液链球菌在人体试验中给药的有效性,最近发现来自嗜粘液链球菌的几种蛋白质具有潜在的信号传导能力也就不足为奇了。最近的一种名为 P9 的 84 kDa 蛋白质(由 Amuc_1831 基因编码),在口服给药后可在小鼠体内诱导血清 GLP-1,体外研究表明 P9 与细胞间粘附分子受体 2 相互作用。另一种最近发现的蛋白质是 50 kDa的 A. muciniphila Amuc_1434* 蛋白质,可以通过肿瘤坏死因子相关的凋亡诱导配体 (TRAIL) ,从而介导凋亡途径抑制 LS174T 细胞活力。然而,这两种蛋白质都存在于除嗜粘液链球菌之外的许多细菌中,它们都被注释为具有酶活性的蛋白酶,并且都没有定位于细胞外,不排除需要细胞裂解的可能性。更重要的是,它们的稳定性尚未得到解决,因为在人类和小鼠模型中,经过巴氏杀菌的嗜粘液链球菌细胞与活细胞一样有效,甚至比活细胞更有效。所有这些论点都不适用于另一种被发现向TLR2发出信号的粘杆菌蛋白(图 4)。这是一种 30 kDa Amuc_1100 蛋白,它被定义为一种外膜蛋白,与疣微菌以外的其他细菌几乎没有同源性,实际上被认为是一种菌毛相关蛋白。进一步的研究表明,Amuc_1100 具有热稳定性,可在小鼠模型中预防饮食诱导的肥胖。当比较三种蛋白质的绝对丰度时,很明显 Amuc_1100 比在粘蛋白上生长的嗜粘液链球菌蛋白质组中的其他两种蛋白丰富得多。因此,未来研究应该确定哪些蛋白质或其组合可以解释观察到在人类中的嗜粘液链球菌活性。
●Newly identified molecules, impact on health and their targets
新发现的分子、对健康的影响及其靶点
经典分子,如被定义为宿主代谢、肠道屏障和炎症的调节剂的SCFA、BA 或 PAMP 和肠道肽(即 GLP-1、PYY),除此以外一类称为“肠合成酶”作用的新型分子出现了。enterosynes 的概念最近被引入,被定义为“源自肠道的分子”,具有通过靶向肠道神经系统 (ENS) 来调节十二指肠收缩的能力。Enterosynes 化学上具有多样性,并与激素、生物活性肽/脂质、营养素、微生物群和免疫因子有关。
肠道微生物组、大脑功能和葡萄糖代谢之间的联系正在成为该研究领域的热门,而 ENS 的作用已成为解决糖尿病等疾病的新目标。尽管各种论文都在讨论调节肠道微生物组的策略,例如益生菌、益生元和粪便移植以减轻代谢综合征,但很少有(如果不是没有的话)关于表征肠道的因素,例如肠素。
为了寻找参与葡萄糖代谢的新型肠道分子和受体,研究了已知的特定纤维改变肠道微生物群和改善糖尿病的作用。通过低聚果糖的给药,控制肠神经元的活动来降低十二指肠收缩频率,结果表明糖尿病小鼠脂肪组织中的高血糖症和炎症标志物减少。通过使用脂质组学分析,发现通过这种低聚果糖喂养,选择性地增加了结肠细胞中肠道生物活性脂质(12-羟基二十碳四烯酸(12-HETE))的丰度。给糖尿病小鼠服用 12-HETE 可改善葡萄糖代谢,同时12-HETE 的作用也在体外得到证实。此外,他们发现这种生物活性脂质作用于十二指肠收缩力的分子机制依赖于 mu-阿片受体 (MOR)(由脑啡肽激活)和 PPARγ 的存在。与健康受试者相比,糖尿病患者十二指肠中 12-HETE 水平降低以及脑啡肽原和 MOR 表达降低均支持了研究结果。
通过使用膳食补充剂的各种方法来解决 IBD,鉴定出具有抗炎特性的新型生物活性脂质。利用 E. coli Nissle 1917 (EcN) 的质谱法,这是一种用于治疗结肠炎的的益生菌菌株,发现 3-羟基十八烯酸 (C18-3OH) 的浓度增加 。为了确定肠道微生物群中存在的其他细菌是否产生 C18-3OH,通过使用低聚果糖调节肠道微生物群,发现口服 C18-3OH 可减少结肠炎。作者发现,低聚果糖的抗炎特性与结肠 C18-3OH 浓度的增加有关。最后,他们确定了产生这种生物活性脂质的特定细菌,并发现 C18-3OH 通过激活 PPARγ起作用。总之,这两个例子表明,肠道微生物群是众多生物活性化合物的来源(图 2),它们作用于参与调节代谢和炎症的宿主受体(图 3)。
通过相关研究及动物试验可知,虽然某些代谢物对健康是必需的,但其他代谢物可能有害。最近研究了三种具有负面影响的代谢物,包括果糖赖氨酸、晚期糖基化终产物 (AGE)、三甲胺 N-氧化物 (TMAO) 和丙酸咪唑 (IMP)。
AGEs 是通过热处理从我们的食物中形成的美拉德反应产物,当蛋白质和氨基酸的游离氨基与还原性碳水化合物反应时,会形成生物利用度低的化合物。大量机制证据表明,AGEs 与 T2D 和 CRC 相关,通过激活 AGEs 受体刺激促炎反应、增加肠道通透性(允许 AGEs 与结肠上皮细胞更紧密的相互作用)以及随之而来的细菌毒素进入体循环。果糖赖氨酸是一种由赖氨酸和葡萄糖形成的无氨酸产品,是主要的饮食之一。
早期的研究表明,大肠杆菌具有消化果糖赖氨酸的能力。最近的分析表明,它可以通过一种新的途径被小肠单胞菌属菌转化为丁酸盐。值得注意的是,通过实验和计算仅在配方奶喂养的婴儿中观察到降解果糖赖氨酸的能力,而在母乳喂养的婴儿中没有观察到,这可能与热处理后配方奶中这种化合物的高含量有关。下一步的研究应该解决果糖赖氨酸和其他 AGEs 在 T2D 和其他疾病中的因果关系以及肠道细菌在其转化中的作用。最近的一项研究还描述了梭状芽孢杆菌和潜在的Oscillibacter spp.1完全利用N-ε-羧甲基赖氨酸(另一种主要 AGE)。
TMAO 与季胺的摄入有关,例如甜菜碱、胆碱和左旋肉碱,它们常见于蔬菜、水果、肉类和海鲜中,是众所周知的细菌渗透保护剂。包括几种变形菌在内的几种肠道细菌可以通过 TMA 裂解酶及其活化酶 (CutCD) 将这些季胺离子转化为乙醛和三甲胺 (TMA)。然后 TMA 可以进入血液并被肝脏中的黄素单加氧酶转化为 TMAO。最近的研究表明,血清中的 TMAO 与动脉粥样硬化和心血管风险密切相关。此外,TMAO 已被证明可促进小鼠模型中动脉粥样硬化斑块的形成,是一种常见的尿毒症毒素。因此,人们对于探索如何让这些季铵离子代谢成不产生TMA或其他TMAO前体的化合物产生了浓厚的兴趣。新的见解来自对拟南芥及其相关肠道分离物 E. maltosivorans 的生化和途径分析,发现在涉及细菌细胞区室的新过程中,它们使甜菜碱和其他季胺脱氨基并导致乙酸盐和丁酸盐的产生。后一种细菌高度相关,并且似乎具有独特的维生素 B 依赖性代谢途径,但这不适用于可能导致 IMP 产生的组氨酸代谢。已有研究表明,T2D 患者血清中会出现 IMP 的浓度增加。
最近发现,肠内细菌通过雷帕霉素复合物1依赖途径的乳腺靶点损害胰岛素信号,从而从组氨酸中产生IMP。变形链球菌和埃格氏菌,这两种不相关的细菌已被确定为是 IMP 生产者,这证实了许多代谢物是由可能没有任何系统发育关系的几类肠道细菌产生的事实。总而言之,这些例子表明肠道细菌参与了产生有害化合物的过程,但也发现了新的厌氧菌,它们可以解毒,甚至将它们转化成具有有益信号传导潜力的物质,如丁酸盐(图 2 和图 3)。
GENERAL CONCLUSION AND PERSPECTIVES
结论和观点
在过去的二十年里,从最初的临床观察到更科学的方法,肠道微生物群和健康领域正在演变为存在无可辩驳的因果关系,但是仍有许多研究实际上只证明了相关性。从相关性转向因果性仍然是一个重要且必要的步骤,以更好地设计基于肠道微生物群调节或使用特定活性化合物的制定干预措施。得益于大量的努力和组学分析的进步,科学界正逐渐走向个性化医疗,微生物群落时代显然是未来医学和营养方法范式转变的重要组成部分。
参考文献
de Vos WM, Tilg H, Van Hul M, et al. Gut microbiome and health: mechanistic insights. Gut. 2022 May;71(5):1020-1032. doi: 10.1136/gutjnl-2021-326789.