肠道微生物组相互作用的规则

文献导读
在人类中,生态位特异性胃肠道微生物组影响益生菌微生物的定植成功。使用预扰动自体粪菌移植可以使抗微生物扰动后的微生物组合成功最容易。
文献信息
- 英文标题:Rules of engagement in the gut micro biome
- 中文标题:肠道微生物组相互作用的规则
- 作者信息:Elze Rackaityte(第一作者)Susan V. Lynch(通信作者)
- 通信地址:Division of Gastroenterology, Department of Medicine, University of California, San Francisco, San Francisco, CA, USA
- DOI: https://doi.org/10.1038/s41591-018-0242-0
综述内容
人类的微生物携带能力既强大要脆弱。它在宿主生命早期迅速增加,并受到一系列环境的影响。反过来,微生物菌株及其生物活性产物,特别是肠道微生物组中的微生物,会影响生理发育和免疫能力从而影响器官功能。微生物组具有对人类健康至关重要的辅助和可塑性功能,引发了人们对肠道微生物组用于预防,治疗和控制疾病的新兴趣。尽管食用粪便微生物以促进健康起源于4世纪的中国文化以及使用特定的益生菌物种的方法可以追溯到20世纪初Eli Metchnikoff的研究,但微生物进入胃肠道后的作用规律仍然难以捉摸。Suez和Zmora等人近期在《细胞》》杂志上发表的论文阐明了在自体粪菌移植(aFMT;在使用抗菌药物前收集的粪便)或由双歧杆菌,乳酸菌和链球菌属的11种益生菌菌株的商业混合物进行移植。
Suez等人在小鼠中证实,在接受aFMT的动物中,肠道微生物组结构和组成对抗前微生物状态的后微生物恢复能力增强。相比之下,持续补充益生菌会延迟小鼠肠道微生物组的重建,这些观察结果与那些接受抗生素治疗的结果是一致的。持续益生菌治疗阻碍了微生物组恢复,自发重建组减缓并由aFMT加速(图1)。此外,在人类中,转录谱分析表明,aFMT促进了十二指肠宿主基因表达的程序,该程序与观察到的预抗菌剂处理没有显著差异,而益生菌补充剂显著改变宿主转录活性。值得注意的是,该试验的aFMT组中的受试者接受了单次粪便移植,而益生菌组中的受试者消耗了11个剂量的益生菌混合物,持续4周,导致微生物组组成改变(来自观察到的预抗菌剂施用)在益生菌补充剂停止后5个月内仍然明显。
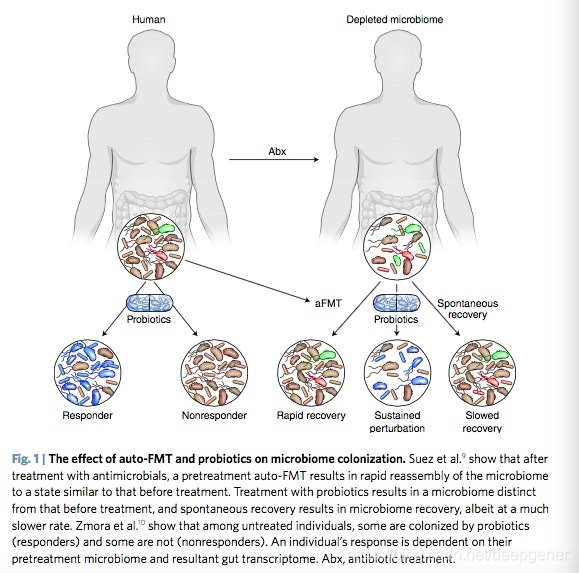
鉴于本研究中使用的特定益生菌产品抑制了健康肠道微生物组的重建并诱导了与预扰动状态不同的宿主转录反应,该研究提供了对次要继承过程的重要见解,即重建人体肠道微生物组中的扰动后的生态系统。作者观察到持续补充相对少量的益生菌菌株对微生物组成和宿主表达产生明显和普遍的影响是令人印象深刻的,并表明下一代益生菌合理设计用于生态位特异性功能属性,菌株相容性和底物利用可能为个性化疾病管理或治愈提供可行的方法。
使用市售产品的口服益生菌补充剂的干扰试验发现每次的干预成功率不一样,而且在人群中对这些补充剂有很高的个体间反应性。Suez等人对传统和无菌的成年鼠补充商用益生菌的研究中证明,沿着胃肠道的长度存在不同的和生态位特异性的微生物组,并提供证据表明胃肠粘膜中微生物之间的竞争水平对于外源细菌物种的定殖成功是至关重要的。他们在常规实验室小鼠身上发现,引入益生菌的微生物组只能在下消化道的官腔中检测到。他们的进一步研究证明,这是由于本地微生物群的竞争性排斥添加相同益生菌的无菌小鼠在消化道和下消化道的粘膜和管腔中都表现出益生菌的富集。此外,尽管常规小鼠中益生菌物种的粘膜定植能力差,但作者指出,与对照(未经处理)小鼠相比,益生菌的引入显著提高了粘膜和管腔内固有细菌的丰度。因此,虽然益生菌并未明显地定殖到下消化道粘膜,但它们在腔中的存在和产物影响粘膜微生物定植模式。
与作者的小鼠研究相比,口服相同的11株益生菌的健康人产生了不同的反应,包括益生菌在不同消化道壁的定植成功和相对富集,突出了小鼠和人类系统之间的关键差异。重要的是,粪便中益生菌的存在与它们在人体粘膜中的检测无关,这表明粪便不足以评估益生菌菌株的粘膜植入。人类受试者对益生菌治疗表现出广泛的二分反应,并且被认为对益生菌菌株的特定定植具有宽容或抵抗能力。
Zmora等人确定了影响益生菌定植成功的因素,其中包括每个生态位中每种益生菌物种的基线丰度,强化了常驻微生物组以及明确了菌株相容性决定了外源细菌菌株定殖成功的事实。与该发现相关,小鼠的转录组学分析揭示了niche-specific转录程序,包括先天和适应性免疫应答和代谢的特征(所有可与微生物组 - 宿主相互作用相关),与定植允许性或抗性表型相关。与定植抗性的人类受试者相比,允许的参与者在盲肠基因表达中表现出显著差异,并且他们的胃肠转录组富集了与树突细胞活性和抗原呈递相关的途径,而抗性受试者表现出与防御革兰氏相关的先天免疫应答的表达增加。阳性细菌(所有益生菌种类均为革兰氏阳性)。因此,引入的微生物物种的成功定殖似乎是基于相同或系统发育相关物种的丰度以及胃肠壁内的主要免疫和代谢条件,其与常驻微生物组密切相关。
尽管Zmora等人对健康成人(这些健康人体内微生物组中经历急性扰动)的参与者中进行研究,对于传统的益生菌属,如乳酸菌,链球菌和双歧杆菌,在慢性条件下,益生菌移植是否会得到增强,目前尚不清楚。此外,尽管病理性微生物组与外源微生物菌株之间的直接竞争可能决定定殖成功,但底物利用,代谢交叉饲养和种间信号传导(微生物和微生物宿主)可能也在决定管腔微生物活动中发挥重要作用,粘膜移植和临床结果,其基础和相对重要性仍有待确定。
综述讨论
这些重要的研究有许多相关的推论。首先,它们提供了一种可行且相对便宜的选择,如aFMT,可以在急性扰动(如抗生素)后成功地、个性化地重组肠道微生物组组成。尽管Zmora等人清楚地证明粪便微生物特征并不能忠实地反映微生物黏膜定植模式,但Suez等人提供的证据表明,粪便中含有足够成功沿胃肠道重建微生物组的成分,因此仍是研究的重要样本。其次,这些研究提供了证据,表明微生物在微扰作用下对局域生态位条件和外源微生物的定植成功产生了强烈的影响,从而揭示了微生物群在次生演替过程中发生的复杂相互作用。此外,这些研究对人类微生物组的建立具有重要意义,也被称为初级演替,并有力地支持了下述假设:在新生儿壁龛中占据先导微生物种可能强烈且持久地支配早期生活中的微生物组和免疫发育轨迹,这些已成为儿童健康的重要预测因子。这些研究为深入了解微生物在人体胃肠道中的作用规律提供了重要依据,并为胃肠道生态位特异性、微生物-微生物-宿主相互作用和菌株相容性是合理设计下一代微生物治疗学的重要因素提供了证据。
参考文献
[1]点击查看原文献
深度基因小伙伴温馨提示:
- 如果我们对文章理解有偏差,非常欢迎大家向我们反馈,我们会认真阅读建议并修改,另外有意愿加入我们的小团队的老师和同学可发送邮件至我们的邮箱:[email protected] 祝大家科研顺利,生活开心!
- 想要了解更多内容请访问我们的深度基因网站:http://deepgener.wordpress.com/
- 点击查看上一篇文章