肿瘤微生物组(Tumor Microbiome)或称瘤内微生物组(Intratumoral Microbiome)是肿瘤微环境中不可或缺的成员,与肿瘤的发生发展乃至治疗紧密相关,正受到越来越多研究者的密切关注。笔者有幸从2020年开始接触和了解肿瘤微生物组的研究方法和策略,并直接参与了许多科研项目的实施,积累了不少一手的材料。以下笔者从多个角度系统地介绍肿瘤微生物组的相关情况,并分享从实战中获取的一些经验和建议。
01
微生物群是肿瘤微环境的内在组成部分
基于肿瘤组织的内在特征,肿瘤病灶可能是支持细菌入侵、存活和生长的理想环境:
(1)肿瘤块通常是一个缺氧环境,其中有限的氧气水平有利于特定细菌种类的生长(例如兼性和严格厌氧菌);
(2)坏死组织通常富含营养物质(如嘌呤),有利于细菌的存活和细胞的快速增殖。同样,肿瘤坏死区域会出现一些化学吸引信号并促进细菌外渗;
(3)随着肿瘤的发展,新的血管出现并围绕着生长的组织。这种血管生成过程会导致在肿瘤细胞周围形成渗漏的脉管系统,随后被循环细菌用于进入组织。细菌可以在细胞外或胞内小室中增殖;
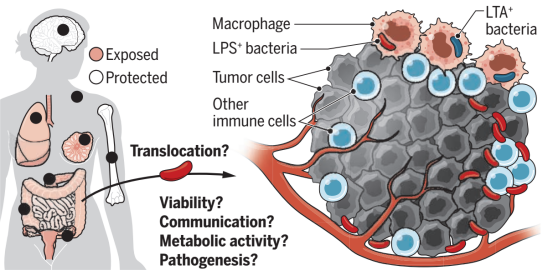
(4)肿瘤是免受宿主免疫监视的。定植细菌利用肿瘤的免疫特权状态轻松增殖,不受宿主免疫系统的任何干扰[1]。事实上,大多数人类癌症类型都有肿瘤内微生物存在的分子证据[2,3],包括位于肿瘤组织外周和内部的细菌群落(图1)。
肿瘤相关微生物群作为肿瘤微环境的内在组成部分,不能再被忽视(【万字综述】Protein & Cell:微生物,肿瘤微环境中的不速之客)。
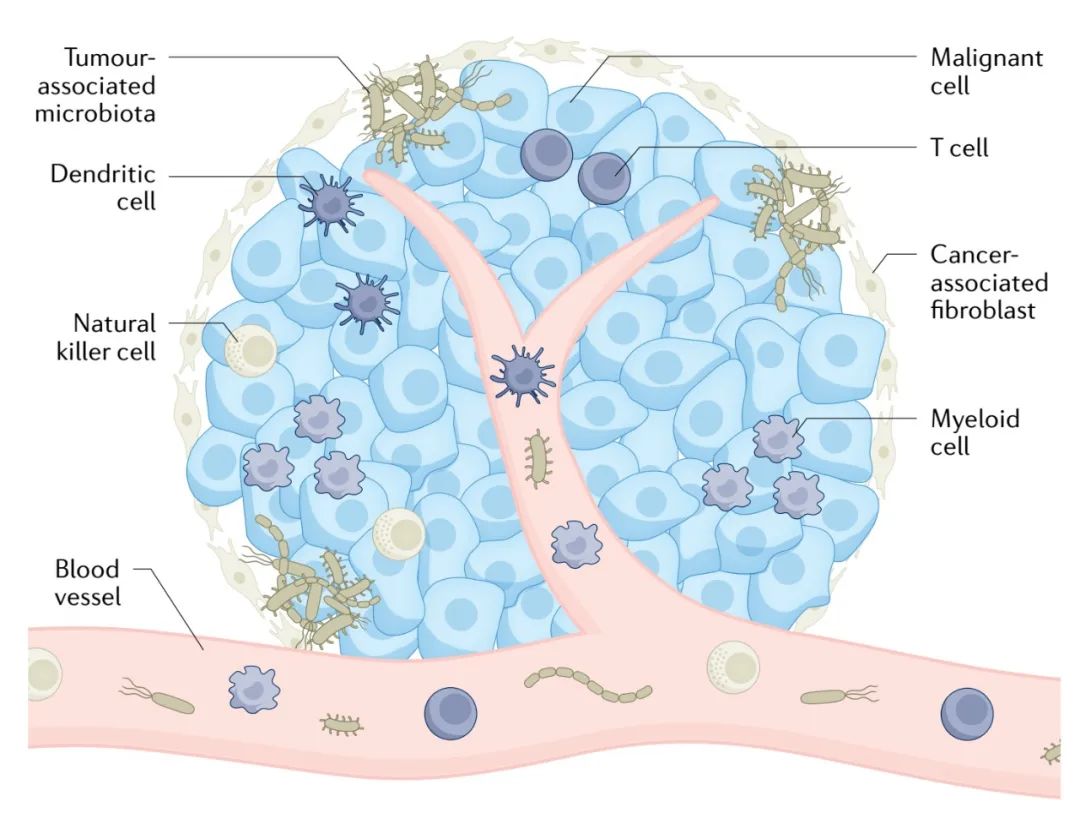
图1 肿瘤相关微生物群
02
肿瘤微生物组研究进展
2022年4月《Cell》报道了西湖大学蔡尚团队首次证实乳腺癌组织中存在多种独特的 “胞内菌”,会调节其宿主细胞的肌动蛋白细胞骨架,助肿瘤细胞在转移过程中抵抗循环系统中的流体剪切应力,促进其存活[4]。2021年《Nature》报道国外团队通过分析9位患者的17个黑色素瘤转移瘤的瘤内菌群以及源于这些细菌的HLA呈递的多肽库,鉴定出源自瘤内细菌的248个HLA-I(人类白细胞抗原)和35个HLA-II多肽,这类细菌多肽可被肿瘤细胞和肿瘤内的抗原呈递细胞所呈递,并能引发T细胞免疫反应[5]。2020年《Science》报道了肿瘤微生物组的里程碑工作,分析了乳腺癌,肺癌,卵巢癌,胰腺癌,黑色素瘤,骨癌,脑瘤7种癌症类型1526个肿瘤及其邻近正常组织的肿瘤微生物组,发现每种肿瘤都有不同的菌群组成,乳腺癌菌群最丰富。同时瘤内细菌具有代谢活性,大部分位于细胞内,在癌细胞和免疫细胞中都存在[3]。同年,《Nature》报道研究团队对TCGA中来自10,481例患者,涉及33个癌种的18,116份全基因组和全转录组数据进行微生物序列分析;发现在大多数主要癌症类型的组织和血液中存在独特的微生物特征;仅用血浆来源的游离微生物核酸可以区分健康,无癌症个体和多种癌症患者[2]。
2021年《Science》专门发表了题为“The microbiome and human cancer”的肿瘤微生物组综述文章,回顾了近期开展的数十项肿瘤微生物组研究,涉及脑癌、头颈癌、食管癌、乳腺癌、肺癌、肝癌、结直肠癌、前列腺癌、卵巢癌、骨癌、白血病等24种癌症类型,研究主题涉及诊断、机制、预后和治疗等领域(图2)[6](【收藏】24类肿瘤的微生物组高分文献集锦(上),【收藏】24类肿瘤的微生物组高分文献集锦(下))。众多令人信服的证据已表明微生物组在癌症的发生、发展和患者对治疗的反应中所起的作用。
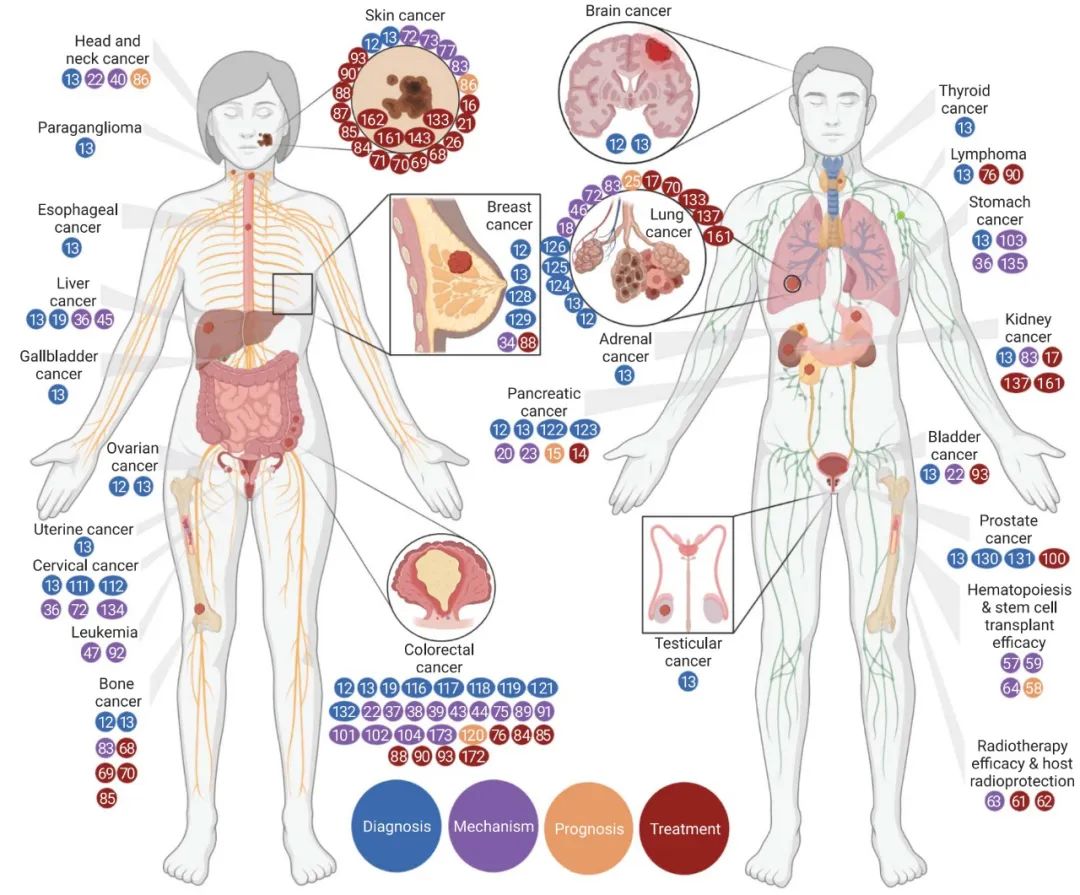
图2 肿瘤微生物组研究全景
彩色圆点反映参考文献号(Science综述),并根据参考论文的主要主题(诊断、机制、预后或治疗)进行着色。
03
微生物群促进肿瘤形成的机制
已有的研究表明,细菌可以通过多种机制促进肿瘤的形成和发展(图3)[1]:
A细菌毒素对DNA的直接损伤作用。
例如,由pks+ E.Coli产生的Colibactin基因毒素可以诱导双链断裂(DSB)、特异的突变特征以及其他形式的DNA损伤,从而导致一种独特的突变特征,这种突变特征在结直肠癌的体外和体内实验都能发现。;
B西式饮食下的细菌新陈代谢。
微生物群在寄主食物成分的代谢中起着至关重要的作用。西式饮食与患多种癌症的风险增加有关,这可能是由于细菌减少了有益的短链脂肪酸(SCFA;因为饮食中的纤维水平较低)的生成,屏障功能降低(如结肠中的粘液更稀薄或更具渗透性),以及细菌产生的致癌代谢物增加,包括硫化氢、N-亚硝基化合物、细胞毒性血红素因子、次级胆汁酸和ω-6多不饱和脂肪酸。这些因素导致ROS的产生(DNA损伤)和组蛋白脱乙酰酶抑制(改变了促炎通路);
C感染、生物膜和炎症。
慢性/复发性细菌感染或侵袭性细菌生物膜可能通过广泛的间接机制促进肿瘤的发生,这些机制与炎症以及通过NFκB转录激活免疫应答有关,包括先天免疫细胞(如中性粒细胞和巨噬细胞)产生的损伤DNA的ROS,以及导致过度增殖导致的癌前细胞突变。许多细胞因子参与了这些促癌炎症过程,包括IL6和IL17。幽门螺杆菌是证据最充分的细菌致癌例子,它不是通过任何直接的产毒机制,而是通过诱导这种慢性炎症反应而导致胃癌。同样,尿路感染(UTI)与随后膀胱癌和肾癌的风险增加有关。炎症性肠病(IBD)具有一个很强的微生物成员,是结肠炎相关结直肠癌的典型例子。许多遗传毒性细菌以及口腔细菌(如具核梭杆菌)也可能促进炎症。至少一些多菌生物膜也是高度促炎的,可能在头颈部鳞状细胞癌(HNSCC)和结直肠癌中发挥作用。最后,牙周病通常与口腔生物膜有关,在流行病学水平上与许多癌症有关,包括HNSCC、肺癌和胰腺导管腺癌(PDAC)。
D抑制抗肿瘤免疫反应。
新近研究数据表明,细菌可以抑制局部自然杀伤(NK)细胞和T细胞介导的对肿瘤细胞的杀伤。值得注意的例子包括具核梭杆菌,它可以通过具核梭杆菌黏附素FAP2结合NK和T细胞TIGIT受体;以及ETBF在结直肠癌动物模型中诱导肿瘤或免疫细胞上的PD-L1。其他机制尚未完全阐明,但有证据表明存在着其他的免疫调节作用。
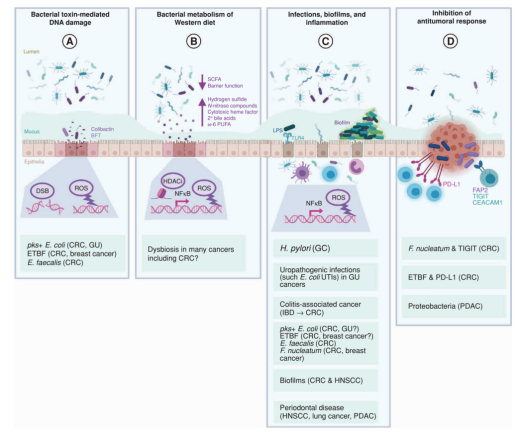
图3 细菌促进肿瘤形成的机制
04
研究肿瘤微生物组的方法

4.1扩增子测序
不同于高生物量的肠道菌群,由于肿瘤组织内的微生物生物量相对较低,并且肿瘤的宿主与细菌的DNA比率很高,与之对应的培养方法也未知,再加上容易受到外部污染,长期以来,表征肿瘤组织微生物群一直是一个挑战(做肿瘤微生物检测,这些问题需重视!)。
下一代测序技术的发展和进步,特别是以检测微生物标记基因(如16S v3-v4区域)为对象的扩增子测序的广泛使用,使得人体微生物群的鉴定驶上了快速道,包括许多基于培养法无法检测的微生物也被快速鉴定出来(微生物16S测序数据的正确打开方式)。常用的菌群多样性分析方案——16S v3-v4已成功应用于肠道菌群、口腔菌群(精华版Cell子刊综述:口腔宿主-微生物相互作用组)、阴道菌群等高微生物生物量样本的检测,然而这个方法用于肿瘤组织微生物鉴定,效果却一般,原因可能是宿主DNA占比过高对实验的干扰,16S v3-v4的检测灵敏度不够高,更不用说核酸降解严重的石蜡包埋肿瘤组织样本(FFPE)。
最近出现的优化升级版16S测序——5R 16S测序,即对16S rRNA基因上的五个区域(V2、V3、V5、V6、V8)进行多重PCR扩增和测序(图4)。与V3V4区扩增策略相比,此方法扩增出的区域覆盖约68%的16S全长序列,可以大幅提高细菌物种检测的覆盖率和分辨率,尤其适合于低生物量的微生物样本检测[3]。不仅如此,5R 16S测序还能兼容有一定程度降解的FFPE样本。
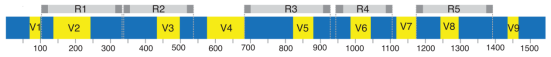
图4 5R 16S扩增16S rRNA基因的5个区域
灰色的R1-R5表示5R 16S扩增的5个区域
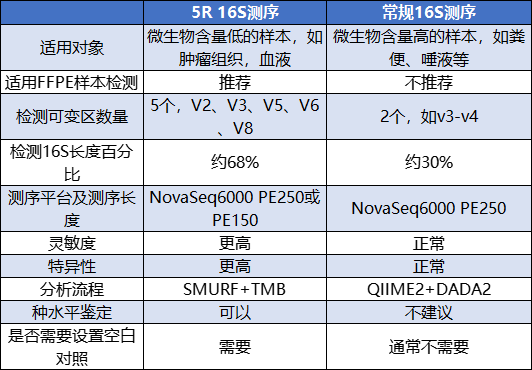
表1 5R 16S测序与常规16S测序比较
我们已将5R 16S测序技术用于数千份肿瘤组织样本(包括几百份FFPE样本)的瘤内细菌群的检测,包括头颈癌、肺癌、乳腺癌、胃癌、肝癌、结直肠癌、胰腺癌、前列腺肿瘤、宫颈癌等(部分为FFPE样本),还有非癌组织包括脑组织、鼻部息肉、消化道粘膜、胸腺导管、肺组织、肝组织、皮肤组织等,以及乳汁、血浆、血清、白细胞、子宫内膜拭子等,整体的检测效果令人满意。由此可以得出,5R 16S测序不仅适用于肿瘤组织微生物的检测,也适用于其他微生物生物量较低样本的检测。我们的用户刘瑶等通过对小鼠静脉注射PBS、Lmo(单核细胞增生李斯特菌)或Lmo@RBC(改造后的单核细胞增生李斯特菌)来比较肿瘤免疫治疗效果,并借助5R 16S测序对肿瘤组织内的菌群进行检测,结果发现李斯特菌仅出现在Lmo和Lmo@RBC组中,并且Lmo@RBC的菌群多样性明显上升(图5)。进一步实验证实,Lmo@RBC可诱导广泛的Gasdmermin依赖性细胞焦亡,从而逆转免疫抑制性肿瘤微环境并促进全身性的抗肿瘤免疫反应[7]。
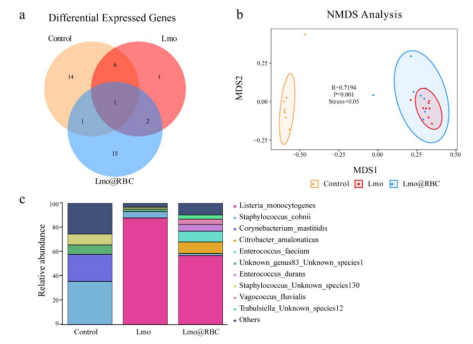
图5 用5R 16S测序评估不同分组小鼠肿瘤组织中的菌群
尽管5R 16S测序具有非常高的检测灵敏度并且适用于降解样本中的微生物检测,然而从大量样本的检测数据中,我们也观察到有一些样本是难以检出菌的,这可能是样本自身的特性,比如菌含量极低,或是样本核酸降解非常严重,也有可能受限于实验技术本身等。
为了顺利地开展肿瘤组织微生物检测,请重视以下环节:
严谨的低生物量的微生物组实验设计(参见附录)
严格的无菌采样和实验操作
充分的多环节(样本采集、样本DNA提取、PCR扩增等)设置阴性空白对照
专门的污染菌去除流程(做肿瘤微生物检测,这些检出的菌可能来自污染!)
肿瘤组织微生物可以做宏基因组测序吗?不推荐。因为从组织中提取的总DNA中绝大部分是人类DNA,宏基因组测序后通常只能获取很小一部分微生物数据可用于后续分析,最后提供的肿瘤微生物群和功能信息很有限(宏基因组测序这么用,让你的微生物研究芜湖起飞)。
除了5R 16S,还有其他方法可以检测和分析肿瘤组织微生物吗?

4.2免疫组织化学
(ImmunoHistoChemistry, IHC)
免疫组织化学(简称免疫组化)是利用抗体和抗原之间的结合具有高度特异性的原理,先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原,通过免疫动物后获得特异性的抗体(可直接购买商业化的抗体),再以此抗体去探测组织或细胞中的同类的抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法将抗原抗体结合的部位显示出来。此方法不仅可以用来检测抗原的表达量也可观察抗原所在位置,是一种定性、定位、定量测定的技术。只要是能够让抗体结合的物质,也就是具有抗原性的物质包括蛋白质、核酸、多糖、病原体等都可检测。
IHC实验的简要过程:首先固定样本,以保留细胞完整性,之后与封闭液共同孵育,避免抗体的非特异结合。随后将样本先后与一抗和二抗孵育,再进行显色,复染,封片,最后通过显微镜分析观察信号。
用IHC检测组织中的细菌,用抗细菌脂多糖(LPS)和脂磷壁酸(LTA)的抗体分别检测革兰氏阴性菌和革兰氏阳性菌(图6)[8,9]。
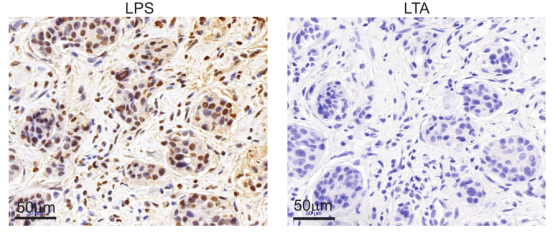
图6 用抗LPS和LTA的抗体分别检测肿瘤组织内革兰氏阴性菌和革兰氏阳性菌

4.3. 荧光原位杂交
(Fluorescence In Situ Hybridization, FISH)
FISH是基于核酸碱基互补配对原则,同源的DNA-DNA,DNA-RNA和RNA-RNA两条核酸单链,在一定条件下结合成双链。荧光素直接标记的核酸探针及靶DNA或RNA,两者混合杂交,互补形成杂交体,最后通过荧光显微镜进行观察,从而实现对靶DNA或RNA的定性、定量和定位分析(图7)。
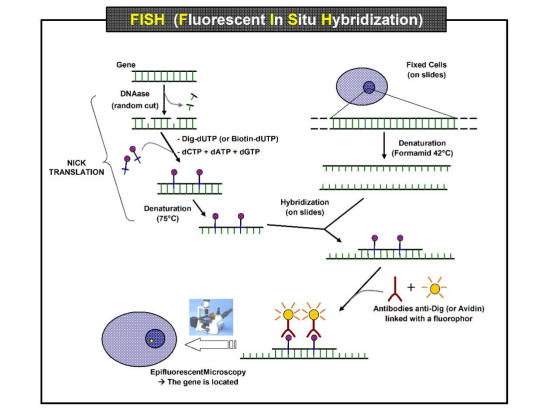
图7 FISH检测原理
FISH简要的实验过程:探针变性、标本变性、杂交、洗脱、杂交信号放大(生物素标记的探针)、复染、封片、荧光显微镜观察FISH结果。
用FISH检测组织中的细菌DNA或RNA,用针对细菌16S rRNA基因的探针进行检测(图8)[10]。
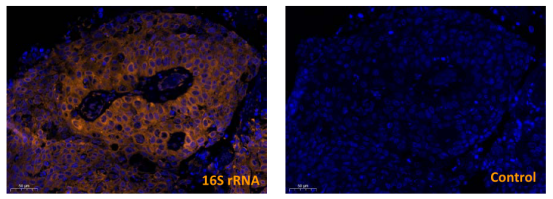
图8 用16S rRNA探针检测肿瘤组织内16S rRNA

4.4 荧光标记的D-丙氨酸原位标记活菌
(Live in-situ bacteria labeling with fluorescent D-alanine)
为什么D-丙氨酸可以用来标记活菌?这是因为D-丙氨酸会被细菌用来生产细胞壁的重要成分肽聚糖,而哺乳动物细胞没有细胞壁,不会使用D-丙氨酸[11]。
要在肿瘤中证实存在具有代谢活性的活细菌,可以通过体外培养新鲜切除的肿瘤切片时,加入荧光标记的D-丙氨酸。若肿瘤中检测出D-丙氨酸的荧光信号,则可以说明肿瘤中含有活的细菌(图9)。
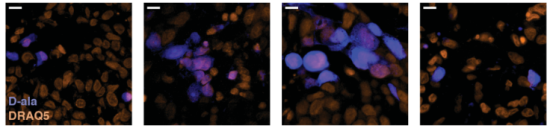
图9 用荧光标记的D-丙氨酸(蓝色)体外培养肿瘤切片。细胞核用DRAQ5染色(橙色)

4.5. 培养组学(Culturomics)
培养组学的基本思路是采用多种培养条件得到菌落,利用MALDI-TOF质谱和16S rRNA基因测序鉴定细菌种属(图10)[12]。随着宏基因组学方法(如16S测序和宏基因组测序)的发展,其基本思想是跳过传统的微生物分离培养,而把微生物群落当做整体来做研究,这使得对微生物的纯培养逐渐被忽视,然而这些方法不能提供微生物的纯培养物,而纯培养物对进一步研究菌株特性、体外模型和宿主感染又是必需的。培养组学技术可以分离得到大量可培养的微生物,发现潜在的新菌种,丰富现有的可培养微生物资源库,并和宏基因组学技术形成互补。
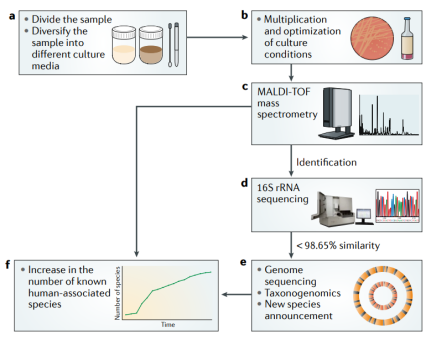
图10 培养组学实验流程图
通过培养组学技术获取肿瘤组织中活菌的简要过程:采集新鲜的肿瘤组织,在无菌条件下温和地解离,然后接种在数十种不同类型的琼脂生长培养基上,并在好氧和厌氧条件下培养,这代表广泛的生长条件,以适应高度多样性的细菌[13]。再利用MALDI-TOF质谱和16S rRNA基因测序(或宏基因组测序)对分离培养得到的代表性菌落进行菌种鉴定。更多内容请查看军科院杨瑞馥、毕玉晶等撰写的《培养组学方法优化》。
05
肿瘤微生物组代表性研究
相比于肠道菌群的研究,肿瘤微生物组的研究目前仍处于早期阶段,许多研究主要关注特定肿瘤的菌群鉴定和多样性分析,也有一些研究已经聚焦在特定菌种在肿瘤发生发展中的功能和作用机制的研究,如具核梭杆菌在结直肠癌、乳腺癌等多种肿瘤中的作用研究[14,15]。现阶段肿瘤微生物组的研究主要集中在四个领域:诊断、机制、预后以及治疗。表2列出了2008-2020年肿瘤组织微生物组代表性研究。
表2 2008-2020年肿瘤组织微生物组代表性研究



点击滑动查看大图
Science:1526份7类肿瘤组织实证肿瘤细胞和免疫细胞中存在细菌[3]

发表期刊:Science
影响因子:47.728
发表时间:2020
研究内容:全面探索人类肿瘤微生物组,揭示不同肿瘤中微生物组的差异及潜在的功能。
实验方法:5R 16S rRNA基因测序
样本数量:1526份样本(不包含阴性空白对照)
样本类型:冻存组织和FFPE样本

实验设计
全面探索7种类型的人类肿瘤微生物组

研究思路与亮点
通过分析乳腺癌,肺癌,卵巢癌,胰腺癌,黑色素瘤,骨癌,脑瘤7种癌症类型1526个肿瘤及其邻近正常组织的微生物群,全面探查人类的肿瘤微生物组,并回答这些问题:肿瘤中是否存在微生物?肿瘤微生物群分布在哪及组成如何?肿瘤微生物群有什么功能?本项工作是迄今为止肿瘤微生物组最全面的研究。

研究结果
从脑部到骨骼的每种肿瘤都存在细菌,且不同类型肿瘤具有其独特的微生物组。其中,乳腺肿瘤中的细菌数量最多且种类最多。还发现瘤内细菌具有代谢活性,大部分位于细胞内,在癌细胞和免疫细胞中都存在。此外,瘤内细菌或其预测的功能,与肿瘤类型和亚型、患者吸烟状况和免疫治疗应答之间存在关联。
详细解读:Science:1526份7类肿瘤组织实证肿瘤细胞和免疫细胞中存在细菌
Nat Commun:定植于乳腺癌的具核梭杆菌加速肿瘤生长和转移[15]

发表期刊:Nature Communications
影响因子:14.919
发表时间:2020
研究内容:具核梭杆菌是如何定植乳腺癌,并加速肿瘤生长和转移。
实验方法:5R 16S rRNA基因测序,RNA-seq
样本类型:乳腺肿瘤组织

实验思路
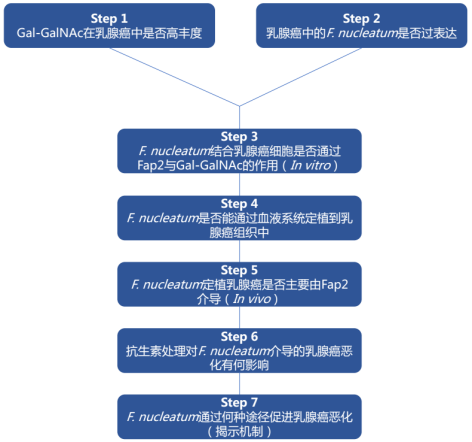

研究结果
具核梭杆菌可通过Fap2与乳腺癌细胞上的Gal-GalNAc结合,从而定植于乳腺癌组织中,并促进乳腺癌生长和转移。使用抗生素(甲硝唑)处理,可抑制具核梭杆菌的促肿瘤作用。

研究亮点
本研究从F. nucleatum在CRC中的研究发现出发,提出合理假设——F. nucleatum是否也结合富含Gal-GalNAc的乳腺肿瘤并在其中发挥作用?围绕假设,作者使用多种检测手段,并结合in vitro和in vivo实验,严谨且扎实地展示和证实F. nucleatum是如何定植到乳腺肿瘤中,又在乳腺肿瘤中发挥何种作用,最后揭示出发挥作用的潜在机制,整个设计值得借鉴。
详细解读:NC文章教你做高质量的肿瘤微生物组研究
ACS Nano:静脉给药活体细菌以引起肿瘤焦亡和抗肿瘤免疫响应[7]

发表期刊:ACS Nano
影响因子:15.881
发表时间:2022
研究内容:通过改造李斯特菌 (Lmo@RBC) 开发一种新的免疫治疗系统并验证其功效。
实验方法:5R 16S rRNA基因测序,RNA-seq
样本类型:肿瘤组织

实验设计
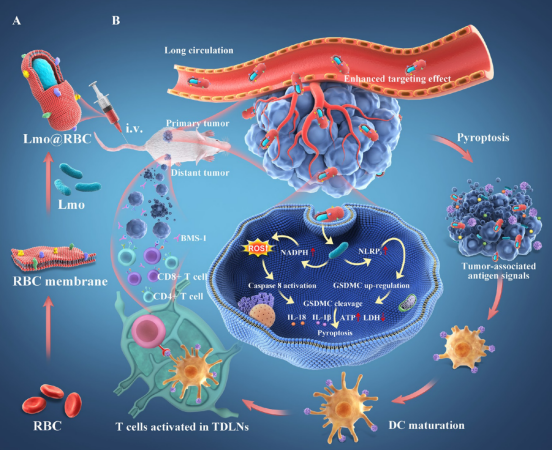

研究结果与亮点
联川生物合作课题组通过改造李斯特菌 (Lmo@RBC) 开发了一种新的免疫治疗系统。借助转录组和肿瘤组织微生物组分析,首次发现 Lmo@RBC可诱导广泛的Gasdmermin依赖性细胞焦亡,从而逆转免疫抑制性肿瘤微环境并促进全身性的抗肿瘤免疫反应,对实体瘤和肿瘤转移有极好的治疗效果。
滑动查看
参考文献:
1.Knippel RJ,et al. The Cancer Microbiome: Recent Highlights and Knowledge Gaps. Cancer Discov. 2021 Oct;11(10):2378-2395.。
2.Poore, G. D. et al. Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature 579, 567–574 (2020).
3.Nejman, D. et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 368, 973–980 (2020)
4.Fu A, et al. Tumor-resident intracellular microbiota promotes metastatic colonization in breast cancer. Cell. 2022 Apr 14;185(8):1356-1372.
5.Kalaora S, et al. Identification of bacteria-derived HLA-bound peptides in melanoma. Nature. 2021 Apr;592(7852):138-143.
6.Sepich-Poore GD, et al. The microbiome and human cancer. Science. 2021 Mar 26;371(6536):eabc4552.
7.Liu Y, et al. Intravenous Delivery of Living Listeria monocytogenes Elicits Gasdmermin-Dependent Tumor Pyroptosis and Motivates Anti-Tumor Immune Response. ACS Nano. 2022 Mar 22;16(3):4102-4115.
8.Raetz CR, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem. 2002;71:635-700.
9.Fischer W. Lipoteichoic acids and lipoglycans. In: Ghuysen JM, Hakenbeck R (eds) Bacterial cell wall. New comprehensive biochemistry. 1994; 27:199-215.
10.Amann RI, Binder BJ, Olson RJ, Chisholm SW, Devereux R, Stahl DA. Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations. Appl Environ Microbiol. 1990 Jun;56(6):1919-25.
11.Siegrist MS, Whiteside S, Jewett JC, Aditham A, Cava F, Bertozzi CR. (D)-Amino acid chemical reporters reveal peptidoglycan dynamics of an intracellular pathogen. ACS Chem Biol. 2013 Mar 15;8(3):500-5.
12.Lagier JC, Dubourg G, Million M, Cadoret F, Bilen M, Fenollar F, Levasseur A, Rolain JM, Fournier PE, Raoult D. Culturing the human microbiota and culturomics. Nat Rev Microbiol. 2018 May 1;16:540-550.
13.Lau JT, Whelan FJ, Herath I, Lee CH, Collins SM, Bercik P, Surette MG. Capturing the diversity of the human gut microbiota through culture-enriched molecular profiling. Genome Med. 2016 Jul 1;8(1):72.
14.Bullman S, et al. Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science. 2017;358:1443–1448.
15. Parhi L, et al. Breast cancer colonization by Fusobacterium nucleatum accelerates tumor growth and metastatic progression. Nat Commun. 2020 Jun 26;11(1):3259.

附录
低生物量的微生物组实验设计指南
01
参照RIDE checklist

RIDE checklist提供给研究者一个可参照的开展低微生物量样本的微生物组研究的最低标准检查表,于2018年首次在Trends in Microbiology上提出。这个检查表包括四部分内容:
(Report) 报告用于减少污染并评估污染影响的实验设计和方法;
(Include) 包括评估污染DNA的控制措施。每批取样、核酸提取以及扩增必须包括一种类型的阴性对照(取样空白对照、DNA提取空白对照和无模板扩增对照);
(Determine) 通过将生物样本与对照进行比较来确定污染程度;
(Explore) 探索每项研究中的污染菌群,并报告它们对生物样本解释的影响。
02
减少取样和操作过程中的实验偏差和污染
建议不同的样本组或处理应随机进行,而不是单独操作。研究人员应戴一次性实验手套,戴口罩,避免皮肤裸露,以减少污染DNA进入样本。应将尽可能多的流程(例如,样本转移、DNA提取、文库制备以及测序)放在清洁、独立的工作环境中进行,而使用到的设备和耗材都应经过必要的去污染处理(图1)。
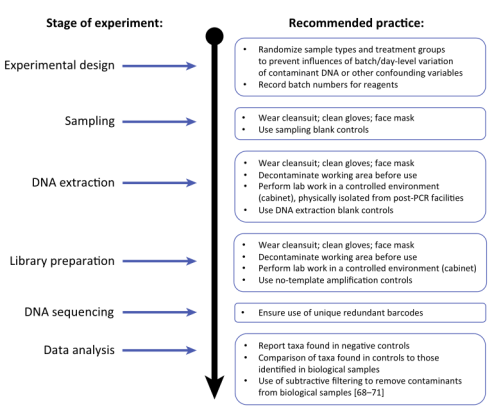
图1 降低低微生物量样本中污染物DNA影响的建议方案
03
从采样到测序都设置对照
在对低微生物量样本进行菌群16S测序时,应在多个实验环节上设置对照,包括用于监测污染DNA背景水平的阴性对照:(i)采样空白对照,(ii)DNA提取空白对照,和(iii)无模板扩增对照。此外,如需确定检测极限,并确认交叉污染不会影响研究结果,则可以设置两种类型的阳性对照:(iv)DNA提取阳性对照和(v)阳性扩增对照。尽管阴性对照样本通常会产生数量和质量较低的文库,但仍然应该对它们进行测序和下游的数据分析,以便与实验样本进行比较,去除污染菌。
(i)采样空白对照
这可以检测采样过程中引入的污染物DNA,包括用于采集样本的物品,如棉签、纱布等,用于储存或运输样本的任何试剂或防腐剂(如培养基、酒精或RNA稳定剂)。在取样空白中检测的材料应与生物样本同时在同一房间内采集,并应与生物样本从采集到测序进行相同的实验处理。虽然采样对照将包含提取过程中的DNA,但它将使研究人员能够辨别哪些污染物是特定于采样地点和设备的,而不是实验室。
(ii)DNA提取空白对照
这会在DNA提取过程中监测提取试剂盒、分子试剂和实验室环境中的污染物DNA含量,如上所述,应与生物样本一起从提取到测序进行相同的处理。
(iii)无模板扩增对照
这会在文库制备和测序过程中监测试剂和实验室环境中存在的污染物DNA。所有阴性对照提供了背景污染物的半定量估算,并允许研究人员识别可用于下游扣除分析的污染物。
04
严格评估和报告分析过程中污染的贡献
目前有三种不同的策略来评估微生物组数据中污染的影响:(i)将对照与生物样本进行比较,(ii)从生物样本中扣除污染物,以及(iii)使用预测模型来识别假定的污染物。每种方法的严格程度和适用范围各不相同。
(i) 生物样本与对照的比较可用来评估污染程度和污染物类别。必须测定每批样本的污染水平(即污染DNA的本底水平),因为污染DNA的水平会因不同的方法学和时间而变化。在阴性对照中检测到的菌群必须报告。这对于确保样本类型或处理之间的菌群丰度或组成的显著差异不是由污染的菌群驱动的尤其重要。
(ii) 在阴性对照中检测到的污染物菌群可以在分析过程中从生物样本中扣除(过滤)。一种方法是从生物样本中去除在阴性对照中发现的所有菌群。这是一种极其保守的方法,可能会导致生物样本中的DNA交叉污染到阴性对照中而导致生物信号的丢失。此外,与常见污染物菌群密切相关的菌群可能真的存在于生物标本中(例如假单胞菌),但会被这种方法去除。在交叉污染严重或者猜测生物样本中存在与常见DNA污染物密切相关的菌群时,建议使用更细致的过滤方法,可以更好地识别要扣除的污染物。最后,如果污染物菌群在过滤后仍驱动生物信号,则应使用不同的方法进行验证,例如FISH。
(iii)生物信息学模型可用来评估生物样本中污染菌群的来源和比例。例如,SourceTracker分析使用贝叶斯建模来估计来自数据集的潜在污染物菌群的比例。为此,空白对照可以作为污染物的“源”,生物样本可以作为“汇”来估计生物样本中污染物菌群的来源和丰度。随后,样本中污染物DNA的相对贡献可以考虑到下游分析和数据解释中。
参考文献
Eisenhofer R, Minich JJ, Marotz C, et al. Contamination in Low Microbial Biomass Microbiome Studies: Issues and Recommendations. Trends Microbiol. 2019 Feb;27(2):105-117.

吴鹏 | 联川生物
高级产品经理
拥有超过十年的基因测序领域多组学科研服务经验。目前负责联川生物微生物组学产品的研发和优化,主持微生物多组学的联合分析平台搭建。在肠道菌群、口腔菌群以及肿瘤微生物组等科研应用上有丰富的实战经验,并将这些经验集结汇编成《医学微生物组实战指南》。
相
关
阅
读
宏基因组测序这么用,让你的微生物研究芜湖起飞 | 微生物专题
【万字综述】Protein & Cell:微生物,肿瘤微环境中的不速之客 | 微生物专题
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
文献阅读 热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
点击阅读原文,跳转最新文章目录阅读