版权声明:转载请随意! https://blog.csdn.net/m0_38032942/article/details/82469666 </div>
<div id="content_views" class="markdown_views prism-atom-one-light">
<!-- flowchart 箭头图标 勿删 -->
<svg xmlns="http://www.w3.org/2000/svg" style="display: none;"><path stroke-linecap="round" d="M5,0 0,2.5 5,5z" id="raphael-marker-block" style="-webkit-tap-highlight-color: rgba(0, 0, 0, 0);"></path></svg>
<h2><a name="t0" target="_blank"></a><a id="_0" target="_blank"></a>热力学系统的分类</h2>
开放系统:有物质交换、有能量交换、做功
闭口系统:无质量交换,有能量交换、
孤立系统:无物质交换、无能量交换
平衡态:质量不变、物质组成成分比例不变、且 P、V、T 不变
平衡态是一种理想状态,这里说的平衡只是动态平衡,分子仍然在运动,处于平衡态时对应PV图上一个点!
热力学第零定律
如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡!
热力学第零定律用来作为进行体系测量的基本依据,其重要性在于它说明了温度的定义和温度的测量方法。表述如下:可以通过使两个体系相接触,并观察这两个体系的性质是否发生变化而判断这两个体系是否已经达到热平衡。当外界条件不发生变化时,已经达成热平衡状态的体系,其内部的温度是均匀分布的,并具有确定不变的温度值。
理想气体状态方程
Q=ΔE+∫v1v2pdv
热力学第一定律只要始末态为平衡态就可以使用,与中间态无关,而且适用于任何系统
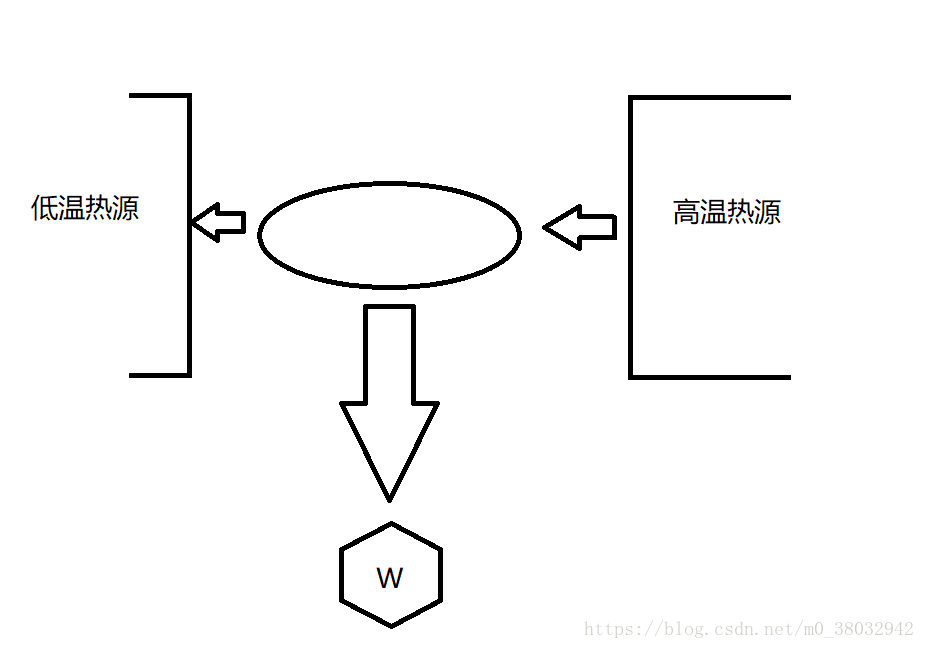
热力学第一定律的另一种表述方式:第一类永动机是不可能实现的
热力学第一定律只要始末态为平衡态就可以使用,与中间态无关,而且适用于任何系统
热力学第一定律的另一种表述方式:第一类永动机是不可能实现的
状态参数的微分特征:全微分
状态参数的积分特征:只与始末状态相关
热力学第一定律的应用
</div>
<link href="https://csdnimg.cn/release/phoenix/mdeditor/markdown_views-2011a91181.css" rel="stylesheet">
</div>
版权声明:转载请随意! https://blog.csdn.net/m0_38032942/article/details/82469666 </div>
<div id="content_views" class="markdown_views prism-atom-one-light">
<!-- flowchart 箭头图标 勿删 -->
<svg xmlns="http://www.w3.org/2000/svg" style="display: none;"><path stroke-linecap="round" d="M5,0 0,2.5 5,5z" id="raphael-marker-block" style="-webkit-tap-highlight-color: rgba(0, 0, 0, 0);"></path></svg>
<h2><a name="t0" target="_blank"></a><a id="_0" target="_blank"></a>热力学系统的分类</h2>