第一章:基本概念
热力学系统的分类
开放系统:有物质交换、有能量交换、做功
闭口系统:无质量交换,有能量交换、
孤立系统:无物质交换、无能量交换
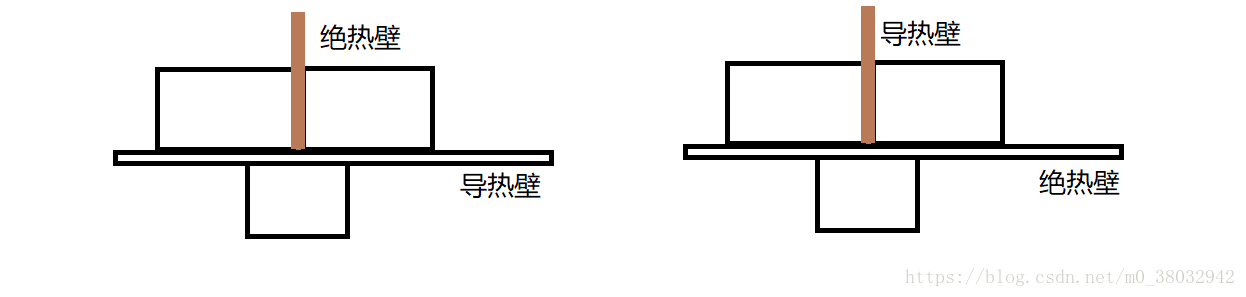
平衡态:质量不变、物质组成成分比例不变、且 P、V、T 不变
平衡态是一种理想状态,这里说的平衡只是动态平衡,分子仍然在运动,处于平衡态时对应PV图上一个点!
热力学第零定律
如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡!
热力学第零定律用来作为进行体系测量的基本依据,其重要性在于它说明了温度的定义和温度的测量方法。表述如下:可以通过使两个体系相接触,并观察这两个体系的性质是否发生变化而判断这两个体系是否已经达到热平衡。当外界条件不发生变化时,已经达成热平衡状态的体系,其内部的温度是均匀分布的,并具有确定不变的温度值。
理想气体状态方程
或者
m为质量,M为摩尔质量
理想气体的定义(下列式子中c为常数):
- 符合波义尔定律:
- 符合盖吕定律:
- 符合查理定律:
- 符合阿伏伽德罗定律:
标准状况: 、
理想气体的内能
i 表示气体分子的自由度
单原子分子
如氦He、氖Ne、氩Ar等分子只有一个原子,可看成自由质点,所以有3个平动自由度 i = t = 3
刚性双原子分子
氢 、氧 、氮 、一氧化碳CO等分子,两个原子间联线距离保持不变。就像两个质点之间由一根质量不计的刚性细杆相连着(如同哑铃),确定其质心O’的空间位置,需3个独立坐标(x,y,z);确定质点联线的空间方位,需两个独立坐标(如α,β),而两质点绕联线的的转动没有意义。所以刚性双原子分子既有3个平动自由度,又有2个转动自由度,总共有5个自由度 i = t + r =3 + 2 = 5
刚性三原子或多原子分子
如H2O 、氨 等,只要各原子不是直线排列的(故CO2的自由度为5,其为直线型),就可以看成自由刚体,共有6个自由度,i = t + r = 3 + 3 = 6
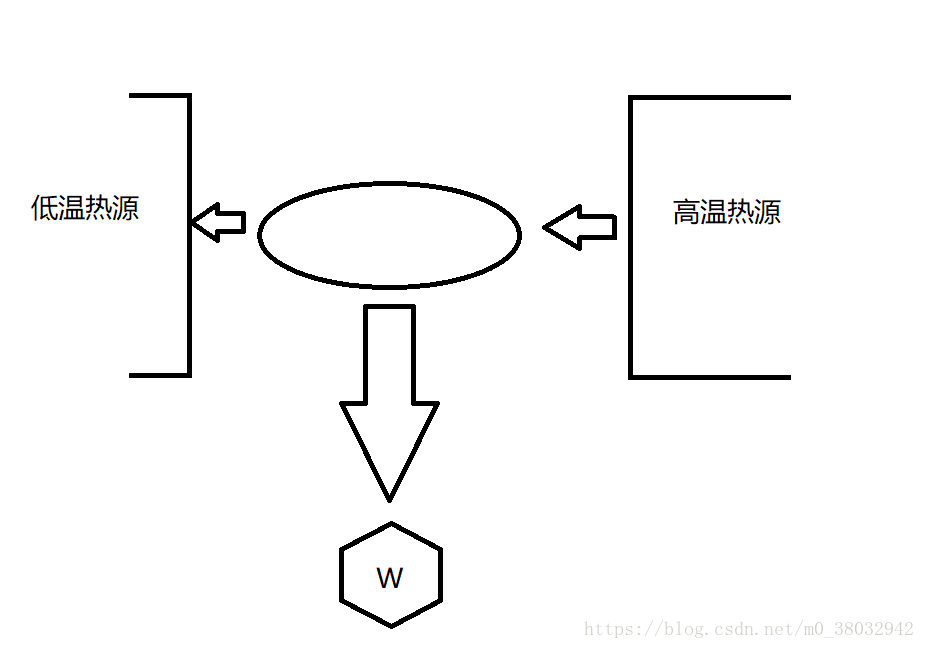
热力学第一定律
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
上式可表述为 内能增量 + 对外做功 = 从外界吸收的热量
对于无限小的状态变化:
对于准静态过程:
热力学第一定律只要始末态为平衡态就可以使用,与中间态无关,而且适用于任何系统
热力学第一定律的另一种表述方式:第一类永动机是不可能实现的
状态参数的微分特征:全微分
状态参数的积分特征:只与始末状态相关