推荐阅读:
溴化乙锭的旧时代
在20世纪90年代早期,定量PCR还处于婴儿期,尽管PCR技术已存在10年,但没有简单的方法可以精确地定量PCR反应中扩增出的DNA数量。在当时,PCR是昂贵的,劳动密集型的,并充满了技术问题,如PCR产物的携带型污染,这使得识别扩增产物的数量相当棘手。
当时,罗氏(Roche)的一个科学家团队率先利用一种著名的荧光DNA结合染料——溴化乙锭,提出了这些问题的解决方案。在循环过程中,在PCR反应中加入溴化乙二胺,这意味着可以将样品置于紫外光下检测终点荧光信号,以确定目标物的存在/不存在(定性)。

但这仍然给科学家们留下了一个问题——如何更容易地量化扩增产物的数量,从而确定他们开始扩增的DNA的数量。qPCR的概念被提出来,即在PCR循环中“实时”检测荧光的产生。当报告荧光信号的数量达到一定的阈值时,可以测量相对数量的DNA (PCR产物)——越早达到阈值,样本的初始量越多。这种连续的荧光测量是当今qPCR技术的基础。
DNA插入(结合)染料登场
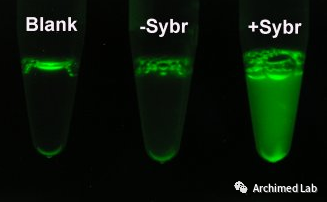
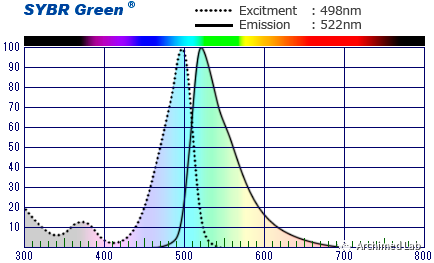
在qPCR反应中使用能够与DNA结合的荧光插入染料,如SYBR GREEN染料。SYBR GREEN优先与双链DNA(dsDNA)结合,但亲和力比溴化乙锭大得多,结合后能够释放很强的荧光信号,便于检测。SYBR GREEN和其他插入染料提高了检测灵敏度,缩短了PCR实验周期。这些染料也更容易定量,因为荧光信号强度与PCR产物数量是成比例的。20多年来,DNA插入染料法作为一种检测方式仍然是基础科学研究中最流行的选择之一。
qPCR探针——下一代qPCR
现在我们有办法轻松地使用荧光染料和更敏感的量化方法,但仍有一些问题,包括产物特异性和扩增目标的信号的不确定性。DNA结合染料与所有双链DNA 结合,无法区分非特异性引物退火或伪引物二聚体所产生的多个产品。
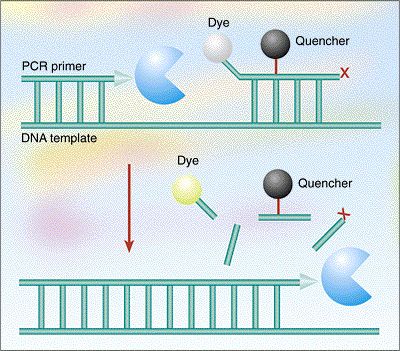
在PCR反应中,除了正向引物和反向引物外,还引入了第三个寡核苷酸序列,这是一个重大的进展。这个额外的序列,就是探针(Probe),它弥补了DNA结合染料的缺点。探针上有荧光修饰基团,可产生荧光信号。探针被设计用来对扩增过程中产生的目标PCR产物进行专门的退火,当杂交时,探针在特定波长光的激发下释放出信号,信号强度表征DNA数量。探针只有与目标序列特异性结合才能发出荧光,这与DNA结合染料法相比,提高了信号释放的特异性。
那么,探针是如何工作的呢?
双标签FRET探针
最常见的探针形式是双标记探针,包括一个在5’端荧光报告基团和一个3’端淬灭基团,两者结合的时候保持淬灭状态(不发光)。荧光报告基团在特定波长被激发,并在较长的波长以光的形式发射这种能量。然而,当被激发的报告基团接近淬灭基团时,该淬灭基团具有重叠的吸收光谱,该光能被转移并淬灭。光能在淬灭基团发射时耗散,允许荧光团在不释放光子的情况下回到基态。这种发生到淬灭的能量转换称为荧光共振能量转移(FRET)。
在与DNA结合之前,荧光基团和淬灭基团可以在探针的任意一端上下跳动,彼此足够接近,报告基团被有效淬灭。在qPCR反应中,当探针与DNA结合形成更刚性的线性双链结构时,荧光基团便会和淬灭基团远离分开,释放出荧光,并标志着PCR产物的产生。
信号传导机制
在每一轮PCR扩增过程中,通常有两种信号传导机制起作用,导致报告基团和淬灭基团分离,发射荧光:
1. 当探针与目标DNA序列结合时——探针到目标链的退火使探针线性化,增加(拉长)了荧光基团和淬灭基团之间的距离。探针上的这两个染料分子之间的距离大到足以阻止有效淬灭。
2. 聚合酶剪切——杂交后,Taq聚合酶利用其5' - 3'外切酶活性将荧光团从探针上切下(水解),探针发出的荧光信号进一步增强。如果探针未被聚合酶剪切,在延伸过程中移位,并可以重新进入其淬灭状态,准备参与下一个反应周期。
在变性和退火温度下观察荧光,杂交和剪切机制如图1所示。
杂交产生两个的荧光信号点,高信号点代表探针结合(退火时),因为探针的线性化阻止了淬灭;随后(变性时),退火期间熔解的探针重新回到离散的淬灭状态,产生低信号点。变性后残留的荧光是来自切割掉探针的信号。一旦报告基团和淬灭基团被剪切,报告基团就会不再被淬灭,因此在杂交过程中,剪切不会产生相同的锯齿形图案。相反,总荧光水平随着探针切割量的增加而增加。
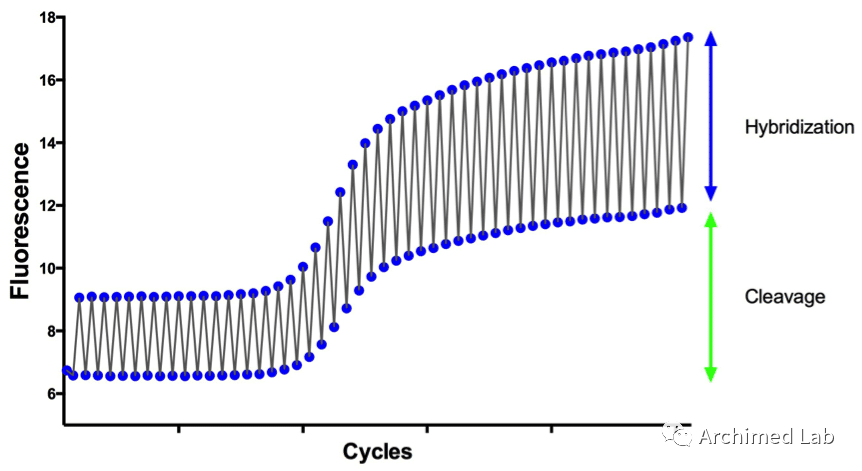
图1. PCR反应中,发生杂交和剪切的荧光变化
淬灭剂的进化
荧光共振能量转移(FRET)是双标记qPCR探针发光背后的物理现象。报告荧光团的发射光谱必须与淬灭染料的吸收光谱充分重叠。
TAMRA
qPCR中最常用的是FAM -TAMRA配对,也是最早出现的染料和淬灭剂组合。当FAM被特定波长激发时,能量被TAMRA吸收,将发射能量转移到较长的波长受体上。因为TAMRA从FAM吸收能量并在更长的波长释放光,所以FAM发出的荧光信号被有效地抑制了。虽然这是一个流行的选择,但这种染料淬灭剂配对有其缺点,即TAMRA本身是带荧光的,因此,它只能淬灭较短的发射波长在绿色和橙色范围内的荧光团,降低了多重反应的能力。此外,TAMRA荧光会增加背景信号进而影响报告基团的信号,使qPCR测量的准确性降低。
暗淬灭剂
新型淬灭染料的出现,解决了缺乏多重反应能力和背景噪声的问题,这种染料在可见光谱中不存在发射光,即所谓的暗淬灭剂(Dark Quenchers)。第一个研制出来的暗淬灭剂包括DABCYL,它与荧光淬灭剂(如TAMRA)不同,它从报告染料(荧光基团)吸收激发能,并以热能而不是光能的形式将其耗散。这种特性省去了背景信号的许多问题。虽然DABCYL非常有效地吸收蓝色和绿色光谱中的光,但它只能吸收很小范围的波长,这限制了它在多重qPCR应用中的应用。
BHQ
黑洞淬灭剂(Black Hole Quencher,BHQ)染料的开发是多重qPCR优化的基础。BHQ染料是一种像DABCYL一样的暗淬灭剂,它吸收光能并将其以热的形式重新发射出来,但能在较长的波长下起作用。这使其在可见光谱中具有高效的淬灭能力,并允许与更大波长范围的荧光团配对。现在有许多BHQ染料可用,每一种都吸收不同波长的光。允许同时使用不同的报告染料。总的来说,BHQ染料的淬灭范围从430 nm到730 nm以上(图2所示)。
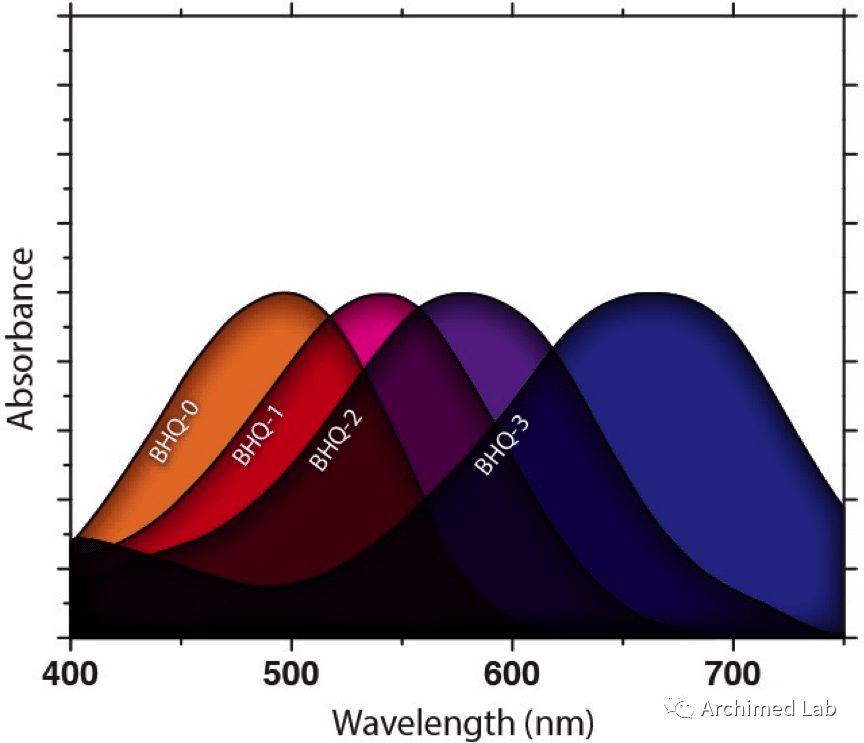
图2. BHQ染料的吸收光谱
参考文献
-
Higuchi et al. (1992) Simultaneous amplification and detection of specific DNA sequences. 10:413.
-
Higuchi et al. (1993) Kinetic PCR analysis: real-time monitoring of DNA amplification reactions. Biotechnology 11:1026
-
Dragan et al. (2012) SYBR Green I: fluorescence properties and interaction with DNA. J Fluoresc 22:1189
-
Schneeberger et al. (1995) Quantitative detection of reverse transcriptase-PCR products by means of a novel and sensitive DNA stain. PCR Methods Appl 4:234
-
Holland et al. (1991) Detection of specific polymerase chain reaction product by utilizing the 5′—-3′ exonuclease activity of Thermus aquaticus DNA polymerase. Proc Natl Acad Sci USA 88:7276
-
Tyagi and Kramer (1996) Molecular beacons: probes that fluoresce upon hybridization. Nat Biotechnol. 14:303.
-
Okamura et al. (2000) Double-labeled donor probe can enhance the signal of fluorescence resonance energy transfer (FRET) in detection of nucleic acid hybridization. Nuc Acid Res 28:e107
-
Chen et al. (1998) Fluorescent, sequence-selective peptide detection by synthetic small molecules. Science 279:851