做一件事的解决方案有很多种,不同的方案会有不同的protocol,那又回到源头问题,到底要选择什么方案?遇到问题的时候到底如何解决?
CRISPR-Cas9基因编辑最常遇到的问题就是:没挑到单克隆、编辑不成功/效率。相信包括我在内的很多CRISPR新手,会将更多的重点放在sgRNA的设计、感染/转染、挑单克隆等等方面,一直到最后基因敲除效率还是很低或者根本没成功。
会首先将原因归结在sgRNA的效率不高,因此会选择重来一次。
同时CRISPR-Cas9的名字也非常具有迷惑性,会让我们潜意识的放在CRISPR-Cas9这两个元件上。
然而,CRISPR-Cas9只是前半部分,后半部分则是DNA repair。
这意味着,即使sgRNA效率非常高,一切都很完美,但如果DNA repair出来岔子,一样前功尽弃。
因此,不要忘了DNA repair在基因编辑中的重要作用。
我们在实验设计阶段就要充分考虑课题目的,选择相应的DNA修复方式。
从文献中我们可以看到,在外界损伤的刺激下,例如细胞内活性氧、电离辐射、紫外损伤以及药物干预等等, 细胞能启动 7 条修复通路来分别应对不同类型的损伤:
(1) 直接修复 (direct repair, DR) 通路;
(2)碱基切除修复 (base excision repair, BER);
(3) 核苷酸切除修复 (nucleotide excision repair, NER);
(4)碱基错配修复 (mismatch repair, MMR) 纠正碱基错配;
(5)同源重组修复 (homologous repair, HR);
(6)非同源的末端连接 (non-homologous end-joining, NHEJ) 通路;
(7)translesion DNA 合成 (translesion DNA synthesis, TLS);
其中后HR,NHEJ通路专门修复 DNA 双链断裂 (DSBs)。
而CRISPR-Cas9的前期原理即是诱导DNA的双键断裂(DSBs),随后依赖DNA修复完成基因编辑工作。
虽然NHEJ和HDR仍然是CRISPR中用于基因修复的主流,但最近微同源末端连接(microhomology-mediated end-joining,MMEJ)的方法也不断活跃在视野中。
这三种DNA修复方式的简略图解如下:
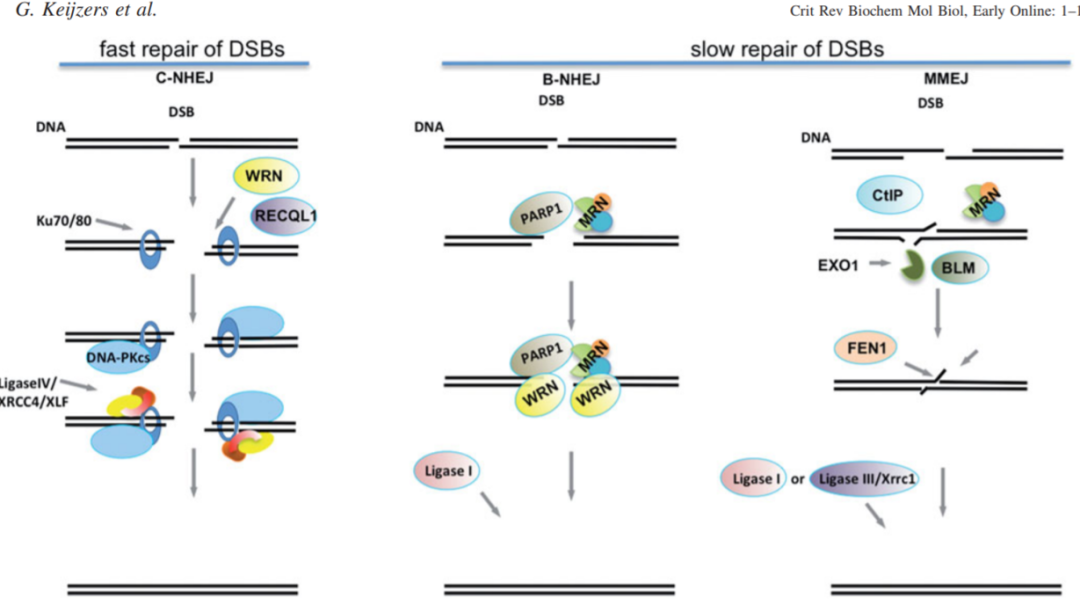
3. CRISPR-Cas9中的DSB修复方式
3.1 NHEJ
非同源末端连接(NHEJ)或经典的非同源末端连接(C-NHEJ)是大多数真核生物修复DSB的主要细胞修复途径。
它发生在细胞周期的所有阶段,通常被认为是一种快速修复机制(大约10分钟)。
从最基本的意义上说,这种机制的工作原理是通过微小的处理将DNA的钝端重新连接在一起。
具体步骤如下:
(1)DSBs形成后,p-γH2AX,ATM套在DSBs两端,同时Ku70/80按顺序套上,接着是DNA-PKcs套上,形成一个连环套,并经由DNA-PKcs将DSBs钝端拉近,并出现Artemis蛋白卡住DSBs两端:


(2)之后在多种酶的作用下,DNA修复如初。
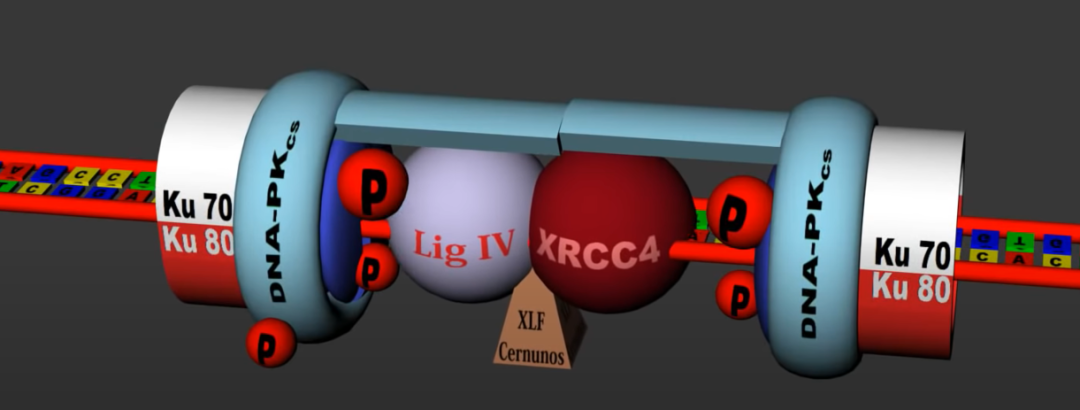
NHEJ具有以下特点:
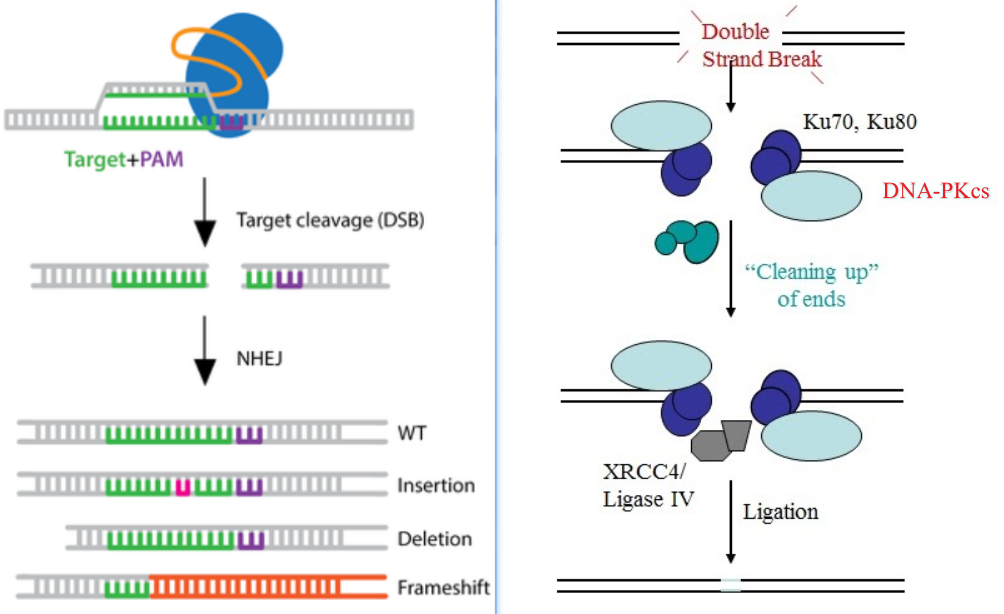
(1)NHEJ介导DSBs修复常常会造成插入缺失错误(indels errors),因此在经常会达成一个双敲(null, knockout)的效果。NHEJ在修复过程中产生的Indels errors通常很小(1-10 bp),但差异极大,因此产生移码突变的几率约为2/3。
(2)NHEJ介导的DSBs修复不一定会引入indels,但Cas9引起的无核苷酸损伤的DSBs仅为5%左右;即使NHEJ修复后没有引入indels,这样的精确修复的目的区域还会再次被Cas9切开,而indels产物则不会。由于单个细胞的分裂和DNA修复周期所需的时间在1小时以内,因此Cas9引入DSBs再经NHEJ修复的过程会不断循环重复,结果是在一天之内大部分染色体上都会被引入indels。由此可见依赖于NHEJ修复方式的CRISPR-Cas9是既快速且效率又高。而我们前面的系列protocol则选用了这一方法。
(3)需要注意的是,Cas9在造成DSBs之后可能不会立刻从DNA上脱落,这也会阻碍DNA的NHEJ修复。
(4)NHEJ结合上成对的sgRNA,也可以达到整段敲除的效果。
(5)NHEJ在整个细胞周期中都是活跃的,其活性从G1期到G2/M递增,即:G1 < S < G2/M。
3.2 HDR
如果说NHEJ是易出错的DNA修复方式,我们利用了NHEJ易出错的特性,从而引入indels。而在更多的时候,我们希望能够达到精准修复的结果,例如镰状红血球贫血症(Sickle-cell anemia, SCA) 等疾病已经明确病因为相关基因突变,如能使用基因编辑技术,精准编辑改变突变位点可达到釜底抽薪的治疗效果。
目前由CRISPR Therapeutics 公司研发的用于治疗β地中海贫血的CRISPR/Cas9疗法 CTX001已经进入临床试验阶段。
这种精准编辑也依赖DNA repair的精准修复,即同源重组修复 (homologous repair, HR;Homology Directed Repair,HDR)。
HDR是真核生物中第二常见的DSB修复机制(除了以HDR为主的芽殖酵母)。与NHEJ不同,HDR依靠同源的修复模板(通常是姐妹染色单体)来修复断裂的DNA。
HDR在S晚期和G2期是活跃的。可以利用HDR机制进行CRISPR-Cas9介导的基因编辑,方法是引入一个外源性DNA模板,该模板包含目的基因的同源序列。
以下图解简单介绍经HDR方式,以CRISPR-Cas9方法精准在基因组中插入序列的步骤。
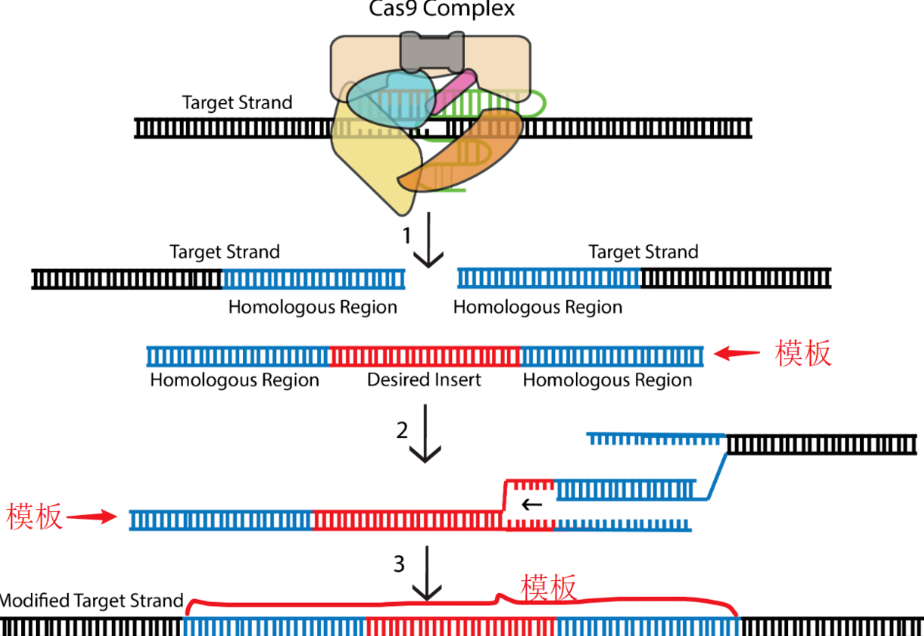
HDR具有以下特点:
(1)HDR要求模板具有足够长的同源臂序列;
(2)HDR活跃于S晚期和G2期;
(3)在设计修复模板时需要注意,ssDNA模板(简称ssODNs)通常用于较小的基因修改,小的插入/编辑可能只需要30-50 bp同源臂,但这个长度并不是绝对,通常使用50-80 bp同源臂;
3.3 MMEJ
微同源末端连接 (microhomology-mediated end-joining,MMEJ) 与NHEJ和HDR相比,MMEJ并没有受到太多的关注。
MMEJ具有以下特点
(1)所需同源臂较短,5-25 bp;
(2)MMEJ在M期和S早期比较活跃;
三种DSB修复方式对比
(1)MMEJ不能像HDR那样完美的精准修复,但它却比NHEJ更容易预测,DSB两侧的短同源区域(5-25 bp)可以定位到基因编辑的目标DNA序列,即精准度:HDR > MMEJ > NHEJ。
(2)但对于没有良好HDR系统的物种,即使存在修复模板,其修复方式仍然是NHEJ;
(3)HDR的同源性越长,重组效率越高,但同源臂越长,克隆时间就越长。相比之下,MMEJ的短同源序列较易通过PCR扩增得到。效率和简单程度:NHEJ > MMEJ > HDR;
(4)NHEJ虽然效率高,但是易出错;HDR精准度最高但是效率却最低;因此在MMEJ活性允许的情况下,也可以达到敲入、替代或删除核苷酸的效果,但效率低于NHEJ;
4. 细胞周期的对DNA repair的影响
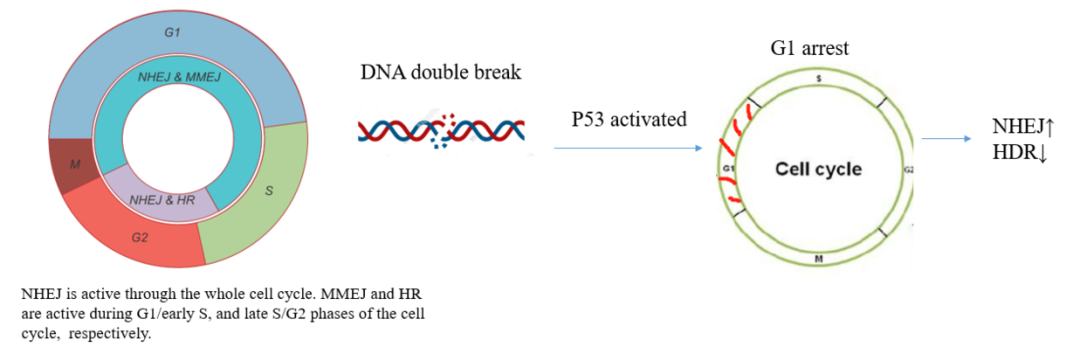
在上文中不断提到不同DNA修复方式在细胞周期中的活跃时间段,例如NHEJ在全周期活跃,并且随着细胞周期的推荐活性更强;HDR则活跃于S末期和G2期,MMEJ则互补性的在M期和S早期活跃。
尤其可见细胞周期的变化也会影响基因编辑的效率。
例如在2018年Nature Medicine的文章CRISPR–Cas9 genome editing induces a p53-mediated DNA damage response中提到,
(1)在常规敲除人视网膜色素上皮细胞(RPE1)中,Cas9诱导的DSBs激活了TP53基因,而TP53基因的激活使得细胞停留在G1期,因此NHEJ活性上调而HDR活性下调(如下图所示);
(2)而敲除TP53基因后,由于TP53激活导致的G1周期停滞被废除,使得细胞周期继续保持正常运行,因此HDR的活性得以保持。
最终的结论是TP53的缺失会促进HDR介导的CRISPR-Cas9,原因则是细胞周期影响。图示如下:
本文试图通过比较不同DSB修复方式的机制以及特点,希望能加深我对CRISPR-Cas9的理解,并进一步了解CIRSPR-Cas9方案设计以及实验失败需要debug时所需要考虑的问题。
当然,如果大家还有问题可以在接下来的2021年3月2日的直播间来一起讨论哦!
