版权声明:如有转载请联系作者本人 https://blog.csdn.net/weixin_42717711/article/details/82767071
医疗器械风险分析是医疗器械注册时必须提交的资料,欧盟CE,美国FDA,中国CFDA 等都明确规定企业在申请医疗器械必须提交医疗器械风险分析资料。所以医疗器械法规知识显得尤为重要,下面是对YY/T 0316的一点学习心得:
1、YY/T 0316-2016和YY/T0316-2008的区别:国家食品药品监督管理总局2016年第25号发布的YY/T0316-2016标准将于2017年1月1日起实施,新版标准将代替YY/T 0316-2008 《医疗器械 风险管理对医疗器械的应用》,与YY/T 0316-2008相比主要修改内容如下:
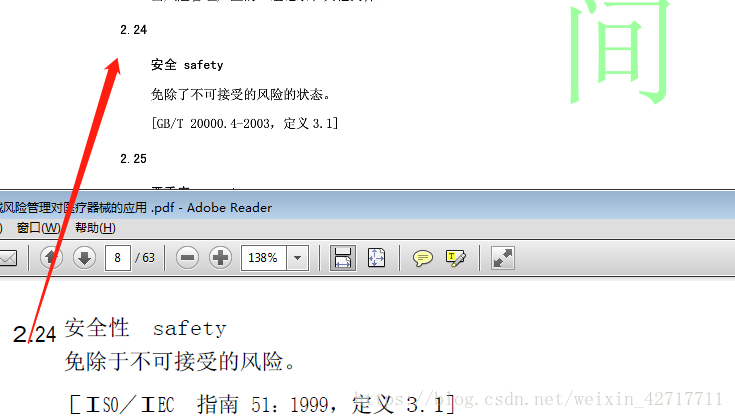
YY/T 0316-2016作为行业标准,为与国标保持一致,即为了与GB/T 20000.4-2003《标准化工作指南 第4部分:标准中涉及安全的内容》中的术语保持一致,修订了下列8个术语和定义:
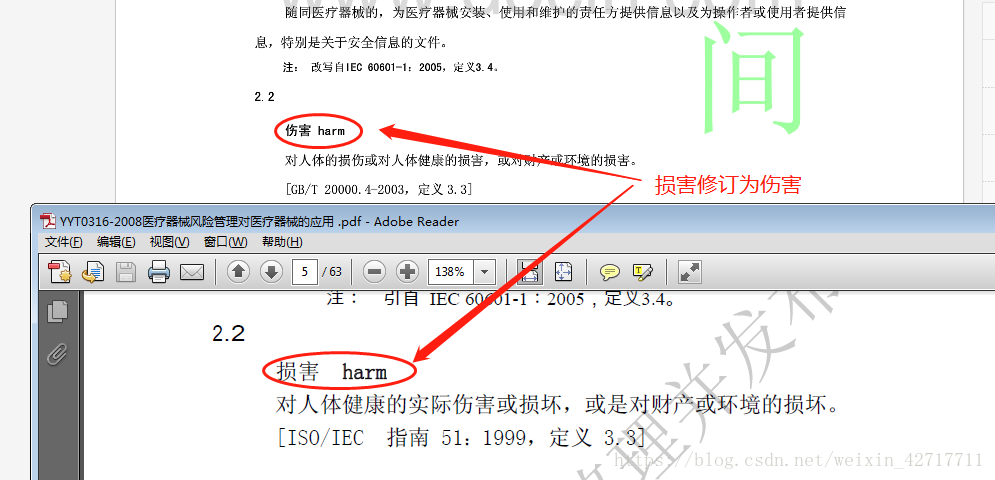
(1)、“损害”修订为“伤害”,并修订定义;
(2)、“危害”修订为“危险(源)”,并修订定义;
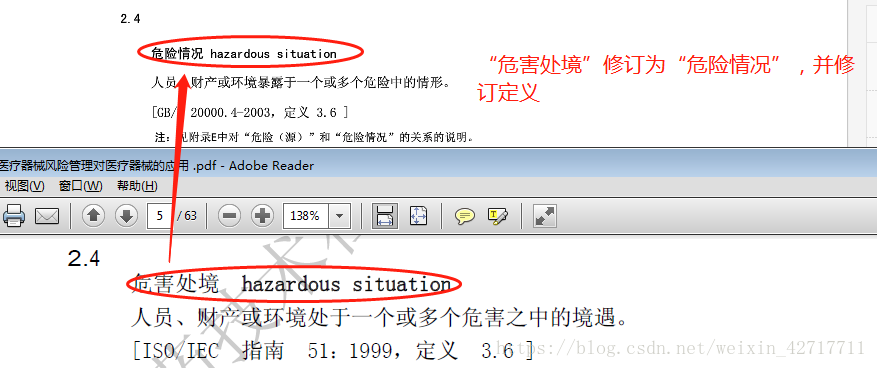
(3)、“危害处境”修订为“危险情况”,并修订定义;
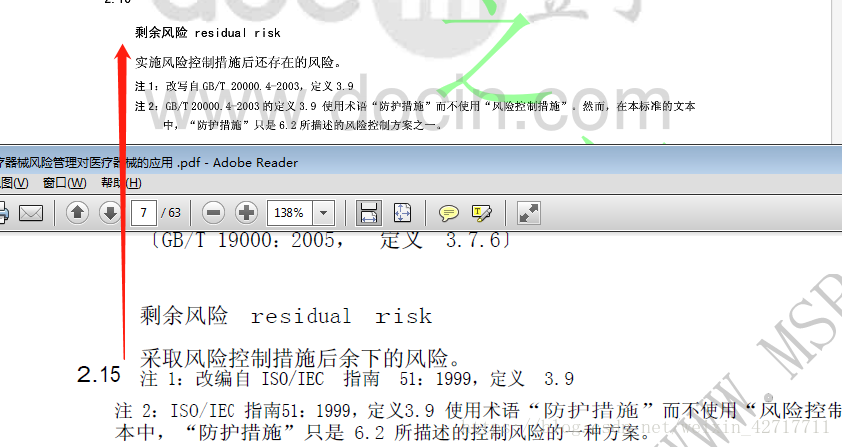
(4)、修订了“剩余风险”定义;
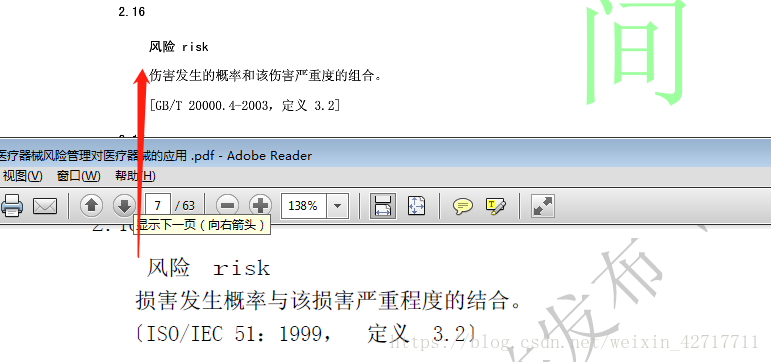
(5)、修订了“风险”定义;
(6)、修订了“风险评定”定义;
(7)、修订了“风险分析”定义;
(8)、“安全性”修订为“安全”,并修订定义;修正了风险管理过程示意图。
2、风险概念具有两个组成部分:(1)、伤害发生的概率;(2)、伤害的后果,亦即,它的严重性如何。
风险管理过程图如下:

待续......