人类肝源干细胞(hLD-SCs)被认为是不可逆肝病患者干细胞治疗的可能来源。然而,目前还不知道肝脏中的hLD-SCs是否能比从其他来源获得的间充质干细胞(MSCs)更好地向肝脏分化。在这项研究中,我们通过诱导肝分化比较了hLD-SCs和人脐带基质干细胞(hUC-MSCs)的分化能力和再生能力。未分化的hLD-SCs表达相对高水平的内胚层相关标记(GATA4和FOXA1).在两种小分子(法舒地尔和5-氮胞苷)支持的定向肝分化过程中,hLD-SCs比hUC-MSCs表现出更高级的线粒体呼吸。此外,hLD-SCs在分化的第14天具有较高数量的肝祖细胞标记物(每千成本(cost per mille)和CD133)并在第7至21天成熟为肝细胞样细胞,肝细胞标记物(白圣职衣,HNF4A,和法新社(Agence France Presse)).在体内细胞移植过程中,hLD-SCs在2 h内迁移到缺血再灌注损伤小鼠的肝脏中,减轻了肝损伤。在硫代乙酰胺(TAA)诱导的肝损伤小鼠模型中,移植的hLD-SCs进入肝脏,并在14天内自发成熟为肝细胞样细胞。这些结果共同表明,hLD-SCs具有更大的肝源性潜力,肝分化诱导的hLD-SCs可能是肝再生干细胞的一个有前途的来源。
肝脏替代疗法或肝移植被认为是终末期肝病患者的金标准[一,2].然而,可用器官的短缺、高成本、移植排斥的风险以及终身免疫抑制的要求削弱了免疫监视系统并增加了肿瘤形成的发生率[3],强制要求寻求替代恢复性办法。干细胞技术的最新进展为再生医学提供了更多可扩展的肝细胞来源,并促进了关于其潜在治疗应用的研究[四].
对于肝损伤的细胞治疗,肝细胞本身已被初步研究。然而,有几个限制——肝细胞在常规环境中培养时会迅速丧失某些功能,并且在冷冻和解冻后表现出显著的丧失;此外,为了获得足够的肝细胞,进入人类肝脏受到限制[5].或者,胚胎干细胞(ESCs)一度被认为是肝细胞样细胞的可能来源,因为它们具有多能性。然而,由于法律问题和道德问题,它们的使用在许多国家仍然受到限制[6].重编程细胞或诱导多能干细胞被广泛认为是胚胎干细胞的替代物;然而,它们的缺点包括高成本和安全性问题,这限制了它们在进一步临床应用中的广泛使用[七].
间充质基质细胞/干细胞可以从不同的组织中分离出来8]并有干细胞标记[9],低免疫原性[10,11]和分化潜能[12].重要的是,间充质干细胞本质上是营养的,它们本身可以对受损组织产生再生作用,包括肝脏[13].例如,先前的研究报告称,系统性施用间充质干细胞导致其募集至缺血或损伤的肝脏区域[14,15,16].此外,已知间充质干细胞分泌肝再生相关生长因子,并可通过减轻氧化应激、抑制凋亡过程、增加血管生成和改善细胞增殖来支持肝再生[17].基于这些发现,从各种器官获得的间充质干细胞最近被探索为更可接受的肝细胞样细胞来源,特别是具有向肝源性谱系分化的能力[18,19,20].
在肝脏中,肝细胞被认为来自至少两种不同的来源。一种是肝祖细胞(在啮齿动物中也称为卵圆细胞)。这些细胞分化为肝细胞和胆管上皮细胞,并在肝脏暴露于急性[21]或慢性损伤[22].啮齿动物卵圆细胞和人类肝祖细胞表达造血干细胞相关标记物[23,24],提示肝祖细胞可能来源于造血干细胞。然而,肝祖细胞的起源还不清楚,仍在争论中22].众所周知,肝祖细胞位于肝内胆管树的最小分支——海林管或肝内胆管。已经广泛研究了它们在慢性和急性肝损伤中的潜在用途。如今,这些双能细胞被认为是具有高分化潜能和可扩展性的肝再生治疗的理想来源。事实上,最近关于肝再生疗法的研究已经使用化学方法将成人肝细胞去分化为肝双能细胞[25,26,27].干细胞疗法目前的另一个趋势是使用化学物质,而不是病毒或基因编辑技术,以避免因改变活生物体而引起的意想不到的副作用[28].综上所述,肝祖细胞显然是肝再生医学的一个有前途的来源。
肝细胞的另一个建议来源是人肝来源的间充质样干细胞(hLD-SCs),它不同于肝祖细胞,对造血干细胞标志物CD34呈阴性。Herrera等人于2006年报道了hLD-SCs的存在及其基本特征29]和Najimi等人,2007年[30].潘[31]和李[32]还报告了类似的hLD-SCs并研究了它们的特性。在啮齿类动物肝脏中观察到了具有类似特性的细胞[33].在王等人的综述中讨论了hLD-SCs34]和Kholodenko等人[35],总结了它们的骨髓间充质干细胞样特性,包括分化能力、免疫抑制作用和在受损组织中的再生作用。然而,围绕hLD-SCs的进一步应用仍存在许多问题。
在目前的研究中,我们跟踪了hLD-SCs肝分化过程中细胞内动力学的变化。此外,由于关于小分子的新证据表明维持或控制骨髓间充质干细胞命运的益处,我们结合小分子诱导干细胞稳定的肝分化[36].小分子可以靶向特定的信号通路来调节干细胞的命运和功能[37].与此相一致,在这项工作中,我们使用了两种不同的小分子。首先是法舒地尔,一种RhoA/ROCK信号抑制剂。已知该分子通过抑制细胞凋亡和增加内胚层分化的效率来维持融合的人骨髓间充质干细胞38,39].另一种是5-氮杂胞苷,一种脱氧核糖核酸甲基转移酶(DNMT)抑制剂。已知5-氮杂胞苷增加肝相关标记基因的表达,并增强分化的肝细胞样细胞的肝功能[40].我们还测量了肝分化过程中hLD-SCs的线粒体功能和代谢状态。还观察到在肝分化的不同时间点诱导小鼠肝损伤期间hLD-SCs在体内分化和成熟为功能性肝细胞的自发事件。总之,本研究强调了hLD-SCs的肝源性潜力以及肝分化诱导的hLD-SCs的显著治疗潜力。
2.材料和方法
2.1.人肝组织中hLD-SCs的分离
我们从访问阿桑医疗中心(韩国首尔)进行活体肝移植并同意提供研究样本的捐赠者那里获得了人类肝脏。人类肝脏捐献者的临床特征列于表1。为了分离hLD-SCs,将小块肝组织转移到冰上,悬浮在5 mL的Dulbecco改良鹰氏培养基(DMEM)/F12 (1:1)中,加入HEPES(Hyclon,GE Healthcare Life Sciences,Logan,UT,USA),然后以500×离心g3分钟。如有必要,将标本转移到培养皿中,并在无菌条件下切成小片。除去上清液,加入5mL 0.1%胶原酶ⅳ溶液(美国纽约州格兰德岛生命科技公司吉博公司)。将组织与胶原酶溶液温育30分钟,并通过轻轻移液进行机械分离。消化后,添加10%胎牛血清(FBS然后用一个70-微米的细胞过滤器过滤悬浮液。将过滤的细胞转移到15毫升离心管中,加入10毫升培养基洗涤,并以400×离心沉淀g持续5分钟3次。将获得的细胞悬浮在添加碱性成纤维细胞生长因子的平板培养基中;Peprotech,Rocky Hill,NJ,USA)通过轻轻移液,计数,并接种在明胶包被的培养板上。在维持和传代hLD-SCs的过程中,不涉及选择过程。这项工作得到了阿桑医疗中心机构审查委员会的批准(授权号2018-1386)。所有志愿者都提供了书面知情同意书。这项研究是根据赫尔辛基宣言进行的。
2.2.人脐带基质干细胞和人骨髓干细胞的制备
hUC-MSCs和HBm-MSCs由干细胞中心(韩国首尔阿山医学中心阿山生命科学研究所)提供。[41,42].简而言之,人类脐带,不包括血管或羊膜,在基本必需培养基中切碎和消化(MEM;Gibco)与0.1%胶原酶A(罗氏,印第安纳波利斯,美国印第安纳州)在37℃下振荡3小时。然后,用70微米过滤器过滤细胞,并在200×离心沉淀g10分钟。将收集的细胞接种于DMEM(吉布科),补充10%胎牛血清、100微克/毫升青霉素和100微克/毫升链霉素,并在37℃的5%一氧化碳中保持2湿化培养箱。
对于骨髓间充质干细胞,骨髓抽吸物取自人髂嵴,用杜尔贝科磷酸盐缓冲盐水(DPBS;Gibco),并在菲科尔-帕克PLUS上分层(密度1.077克/毫升;通用电气医疗保健,皮斯卡塔韦,新泽西州,美国)。在400×密度梯度离心获得单核细胞g室温下培养30分钟,培养条件与人脐带间充质干细胞相同[43].
对于所有干细胞,每3天更换一次生长培养基,直到细胞生长到80%汇合,此时去除非粘附细胞。使用0.25%胰蛋白酶-乙二胺四乙酸溶液(Gibco)分离干细胞单层。所有涉及hUC-MSCs、hBM-MSCs和hLD-SCs的进一步分析均在第4-6代进行,并在第4和第5代汇集用于进一步研究。
2.3.人类干细胞的流式细胞分析
使用前述方法通过流式细胞术测量细胞表面蛋白质[43].hBM-MSCs、hUC-MSCs和3种不同的hLD-SCs依次与一级抗体和二级免疫荧光抗体在冷藏封闭缓冲液中孵育1小时。使用针对PE标记的CD34 (BD Biosciences,Franklin Lakes,NJ,USA)、FITC标记的CD90 (Abcam,Cambridge,MA,USA)和CD105 (Abcam)的抗体,同时也平行检查CD34阳性细胞(补充图S1A).用没有初级抗体的封闭缓冲液孵育的细胞用作阴性对照。共有10,000个事件用BD Facscato II(Becton Dickinson和公司)进行了评估,并使用FlowJo软件(版本10 . 6 . 1;Treestar,Ashland,OR,USA)。
2.4.总基因提取和定量逆转录聚合酶链反应分析
按照制造商的说明,使用RNA微型试剂盒(美国加州巴伦西亚Qiagen)获得所有干细胞、分期肝分化诱导细胞和分离的人原代肝细胞(PHH)的总RNA。对于肝组织,制备了大约40-50毫克的组织,并使用喹唑啉裂解溶液从样品中提取基因(喹唑啉)。互补的脱氧核糖核酸(cDNA)是使用ReverTra Ace qPCR RT Master Mix合成的(日本大阪东洋市),qRT-PCR是使用CFX Connect实时聚合酶链反应检测系统(美国加利福尼亚州赫拉克勒斯市Bio-Rad实验室)用5×HOT FirePol EvaGreen QPcR Supermix(爱沙尼亚塔尔图索利斯BioDyne)进行的。样品在95℃变性15分钟,然后在95℃变性15秒,在60℃退火20秒,在72℃延伸20秒。使用Bio-Rad CFX Maestro软件(CFX Maestro 1.1版)自动确定循环阈值和相对标准化表达;Bio-Rad实验室)。用熔融曲线分析测量特异性扩增。基于δ-δCt方法计算相对表达值,并归一化为磷酸甘油醛脱氢酶表情。引物序列在表2和补充表格S1。
2.5.混合淋巴细胞反应试验
对于单向MLR试验,从2名不同的健康志愿者(献血者1: 36岁女性,亚洲人;献血者2: 29岁女性,亚洲人)通过密度梯度离心法,使用菲科尔-帕克PLUS(通用电气医疗保健公司,皮斯卡塔韦,新泽西州,美国)。用10微克/毫升丝裂霉素C(西格玛·奥尔德里奇,圣路易斯,密苏里州,美国)溶液处理一批多溴联苯俱乐部,制备刺激细胞。1小时后,用补充有10%胎牛血清的RPMI 1640(Hyclon)洗涤细胞至少3次。自体或同种异体骨髓基质干细胞检测是通过在96孔平底培养皿(康宁公司-生命科学,美国北卡罗来纳州达勒姆)(1.0 × 105细胞/孔)。细胞在37℃下用5%一氧化碳孵育2九天。为了测量干细胞对免疫细胞增殖的影响,将人骨髓间充质干细胞、人骨髓间充质干细胞和人骨髓间充质干细胞传代、计数、接种,并与人骨髓间充质干细胞(1.0 × 105细胞/孔)96小时。为了测量增殖指数,根据制造商的说明,使用生存力测定试剂盒(韩国首尔医疗中心)对活细胞进行计数。简而言之,在加入干细胞之前和与干细胞共培养96小时之后,向每个孔中加入细胞存活溶液。孵育2小时后,在450纳米的波长下测量光密度。增殖指数通过将96小时后培养细胞的平均光密度值除以加入干细胞前细胞的平均光密度值来计算(n = 4)。
2.6.免疫荧光测定
细胞在分化0、7、14和21天后用4%甲醛固定。洗涤、透化、封闭固定的细胞,并用白蛋白(1∶100;桑塔克鲁兹生物技术公司,达拉斯,德克萨斯州,美国)抗体在4℃过夜。山羊抗小鼠IgG FITC结合的二级抗体(1:100;桑塔克鲁兹生物技术公司)被用来检测信号。细胞核用4’,6-二氨基-2-苯基吲哚(DAPI)固定液(Abcam)染色。荧光信号用荧光显微镜(AxioObserver Z1卡尔·蔡司,奥伯科钦,德国)。
2.7.干细胞的体外肝分化
肝细胞分化的2步分化方案是从以前报道的骨髓间充质干细胞肝源性分化方案简单修改而来的[19].简而言之,每种干细胞类型被接种在25厘米2测试瓶(美国马萨诸塞州沃尔瑟姆热费希尔科学公司),保存在DMEM/F12(1:1;补充10纳克/毫升碱性成纤维细胞生长因子,1%非必需氨基酸(NEAA;100微克/毫升青霉素、100微克/毫升链霉素和10%胎牛血清,温度为37℃,含5%一氧化碳2在潮湿的培养箱里。2天后,将细胞与步骤1培养基一起孵育,该培养基由伊斯科夫氏改良的杜尔贝科氏培养基(IMDM;Gibco)补充20纳克/毫升HGF (Peprotech),10纳克/毫升碱性成纤维细胞生长因子,0.61毫克/毫升烟酰胺(Sigma Aldrich)7天。两个小分子,5-氮杂胞苷的2微米(西格玛·奥尔德里奇)和法舒地尔-盐酸的10微米(阿多克生物科学公司,加利福尼亚州欧文,美国)在步骤1的分化过程中被加入。对于肝脏成熟,将培养基改为第2步培养基,包括添加20纳克/毫升制瘤素M (R&D系统公司,明尼苏达州明尼阿波利斯市,美国)的IMDM,1%微米地塞米松(西格玛·奥尔德里奇)和50纳克/毫升胰岛素-转铁蛋白-硒;Gibco)最多21天。每隔一天更换所有培养基,显微镜下监测形态学变化(奥林巴斯IX73奥林巴斯,东京,日本)。
2.8.线粒体功能测定(海马测定)
线粒体呼吸功能使用XF细胞有丝分裂压力测试试剂盒在XF24细胞外流量分析仪(安捷伦科技公司,加利福尼亚州圣克拉拉,美国)中进行测量。在线粒体耗氧率测量之前,将第0天和第7天的所有细胞接种在明胶包被的XFe24细胞培养板上(安捷伦科技公司)。由于很难从最初培养的平板上分离第14天的细胞,从第一天开始,所有第14天的肝细胞样细胞都在明胶包被的XFe24细胞培养平板上分化。通过连续加入寡霉素(1.5微米)、羰基氰化物4-(三氟甲氧基)苯基腙(FCCP;1微米),抗霉素A (0.5微米)和鱼藤酮(0.5微米)。三磷酸腺苷产量、最大呼吸、反向能力和非线粒体氧利用率通过前述方法计算44].这些值被标准化为基线耗氧量和细胞DNA量。
2.9.体内干细胞治疗肝损伤模型
在所有体内实验中,hLD-SC 1和hLD-SC 2被用作代表性的hLD-SCs。为了测量干细胞的短期转运,使用了肝脏缺血-再灌注损伤(LIRI)小鼠模型。雄性8周龄C57BL/6J小鼠购自Joongah Bio(韩国京畿道)。为了诱导部分肝脏缺血,使用一个11毫米长的微夹钳(类别号00398-02;精细科学工具,德国海德堡)阻断门静脉45分钟后释放。移除夹子后,用1.0 × 106通过尾静脉注射细胞,然后再灌注6小时
为了测量干细胞在体内的自发分化,8周大的免疫缺陷Rag2-/-Il2rg-/-(NRG)小鼠购自Joongah Bio。为了诱导急性肝衰竭,向小鼠腹腔注射肝毒性化学品硫代乙酰胺(TAA;80毫克/千克)在5天内分两次服用。在第5天,小鼠经脾内途径(1.0 × 10)进行肝分化0、7和14天后,用hUC-MSCs以及hLD-SC 1或hLD-SC 2细胞进行处理6每只小鼠的细胞)。所有小鼠在细胞移植后允许恢复14天。
所有动物实验均按照ILAR实验动物资源研究所的相关指南和规定进行。本研究方案由Asan医学中心Asan生命科学研究所机构动物护理和使用委员会(IACUC)审查和批准(授权号2018-12-167)。
2.10.DiR细胞标记和体内荧光成像
共1.0 × 106细胞用异种光标记(Perkin Elmer,Waltham,MA,USA)。染色程序按照制造商的说明进行。简而言之,细胞在37℃下用DiR处理30分钟,在400 ×下离心3分钟g室温下,用PBS洗涤两次。在所有情况下,DiR标记的细胞悬浮在盐水中,然后在标记后2小时内通过尾静脉静脉注射。在拍摄荧光图像之前,去除C57BL/6小鼠的毛发以避免在检测荧光信号时的任何干扰。在注射后1、2、4和6小时,使用色诺根IVIS光谱系统获得荧光图像。所有图像都是在748纳米激发和780纳米发射下获得的。
2.11.血清测量分析
从小鼠的下腔静脉获得全血样品,并在血清分离管(SSTs贝克顿·迪金森公司)。不锈钢管在室温(22±2℃)下孵育30分钟,并以2500×离心g在4℃保持20分钟。收集上清液并作为血清样品储存。血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平由日立7180自动分析仪(日本东京)分析。
2.12.小鼠肝脏中人基因的检测
为了测量用人干细胞处理的小鼠中剩余的人细胞,使用聚合酶链反应检测人特异性线粒体DNA (mtDNA)和人特异性基因组DNA (gDNA)。从福尔马林固定、石蜡包埋的组织样本中提取总DNA。使用切片机切割固定样品,用二甲苯脱蜡,用无水乙醇洗涤,然后使用FavorPrep组织基因组DNA提取迷你试剂盒(类别号FATGK 001-2;Favorgen,屏东,台湾)。对于阳性人类样本,市售的正常肝细胞系HeParg(1×105细胞;类别号HPRGC10Gibco),并根据相同的方法提取总DNA。小鼠基因组磷酸甘油醛脱氢酶被用作内部控制。引物序列列于表2。
2.13.组织学分析和免疫组织化学
肝组织被切除,固定在4%福尔马林中,并包埋在石蜡中。石蜡块用切片机切片,产生4个微米厚的切片。为了评估肝损伤的严重程度,采用铃木法对H&E染色的载玻片进行评分,并根据3名病理学家(表3;分数范围,0–4)[45].
对于免疫组织化学(IHC),切片在二甲苯中脱蜡,使用乙醇梯度再水合,在10毫米柠檬酸盐缓冲液(pH 6.0)中煮沸20分钟以回收抗原,然后用0.3%甲醇中的过氧化氢处理以去除内源性过氧化物酶。Vectastain精英ABC HRP套件(类别号PK-7200;矢量实验室,伯林盖姆,加利福尼亚州,美国)是根据制造商的说明使用的。stem 121(1:1000;类别号Y40410Takara Bio Inc,Kusatsu,Shiga,日本)和白蛋白抗体(1:200;猫号sc-271605,桑塔克鲁兹生物技术公司)在Dako REAL抗体稀释液(猫号s 202230-2;安捷伦科技公司),并在4℃孵育过夜。安捷伦科技公司)根据制造商的说明使用。切片用QS苏木精复染(载体实验室)并用载体计数仪(载体实验室)固定。组织学图像通过使用照相机的光学显微镜获得(奥林巴斯DP27奥林巴斯,梅尔维尔,纽约,美国)。在放大100倍的图像中,用图像分析软件(NIH)测量阳性染色面积。
2.14.统计分析
所有统计分析均使用GraphPad Prism 6.0软件(GraphPad软件,美国加利福尼亚州圣地亚哥)进行。组织学评分以中位数和范围表示。所有其他数据以平均标准偏差(SD)表示。使用单向或双向方差分析(ANOVA)进行3个或更多比较集的统计分析,随后使用Bonferroni的多重比较测试,并使用学生的t检验进行两组比较。P%3C 0.05被认为具有统计学意义。
3.结果
3.1.hLD-SCs的表征
从形态学上看,培养的hLD-SCs呈纺锤形,细胞核呈卵圆形(图1a)。我们观察到hBM-MSCs和hUC-MSCs在形态学上的相似性。流式细胞术显示,不仅人骨髓间充质干细胞,而且人骨髓间充质干细胞也表达骨髓间充质干细胞表面标记CD90和CD105,而所有人骨髓间充质干细胞和人骨髓间充质干细胞的造血干细胞标记CD34(图1b;CD34阳性细胞的数据见补充图S1A).
hLD-SCs也表达代表性的干细胞标记,即八聚体结合转录因子4(OCT4),NANOG,和性别决定区域Y -框2(SOX2) (图1c)。与骨髓间充质干细胞相比,骨髓间充质干细胞的表达水平OCT4,NANOG,和SOX2在hUC-MSCs、hLD-SC 1和hLD-SC 3细胞中表达相对较低,而hLD-SC 2细胞表达相对较高。
众所周知,骨髓间充质干细胞通过分泌细胞因子参与细胞间的直接接触和细胞间的间接交流,尽管其确切作用尚不完全清楚[46],因此我们比较了这些细胞中的促炎和抗炎细胞因子。在促炎细胞因子中,肿瘤坏死因子α(肿瘤坏死因子α)与hBM-MSCs相比,hUC-MSCs和所有hLD-SCs的水平明显较低。在人骨髓间充质干细胞和人骨髓间充质干细胞中,人骨髓间充质干细胞表达水平最低肿瘤坏死因子α和IL1β。然而,IL1β在hUC-MSCs和三种hLD-SCs中相对较高。所有hUC-MSCs和hLD-SCs均表达较高水平的白细胞介素6(IL6)而hLD-SC 2细胞表达最高水平(图1d)。抗炎细胞因子,转化生长因子β1(转化生长因子β1),而另一种抗炎细胞因子白细胞介素10(IL10),在hUC-MSCs和两个hLD-SCs中表达相对较高,在hLD-SC 1细胞中表达最高。的表达IL10在hLD-SC 3细胞中最低(图1e)。
细胞因子表达不一致的原因尚不清楚,但可能是由于肝脏供体的多样性导致了差异。众所周知,细胞因子的表达因年龄、性别和疾病经历而异[47].在三个hLD-SCs中,hLD-SC 1来自一名21岁的男性,表达的HLd-Sc 1相对较高。肿瘤坏死因子α,IL1β,和IL10。hLD-SC 2的供体是一名38岁的女性,在三名肝脏供体中,38岁供体血清中的甘油三酯(TAG)含量相对较高(157 mg/dl),但没有超过正常范围。hLD-SC 2细胞表达最高水平的多能性标记IL6。hLD-SC 3细胞分离自一名血清总胆固醇(235 mg/dl)和高密度脂蛋白(HDL)-胆固醇(90 mg/dl)升高的27岁女性。hLD-SC 3细胞表达相对少量的。肿瘤坏死因子α,IL1β,转化生长因子β1,和IL10。虽然没有足够的病例来概括供肝者和获得的hLD-SCs之间的关系,但根据我们的证据,供肝者的健康状况似乎与获得的hLD-SCs有关。
由于间充质干细胞抑制免疫细胞增殖[48】,我们测试了hLD-SCs是否可能具有类似的免疫调节能力。为了诱导免疫细胞增殖,从两个同种异体个体获得的外周血单个核细胞被共培养。在倒置显微镜下观察用每种类型的干细胞处理后的同种异体反应和免疫细胞增殖的抑制(图1f)。与自体免疫细胞增殖率相比,同种异体外周血单个核细胞表现出显著的(p%3C 0.001)扩散。这种增殖显著(p%3C 0.001)在用血红蛋白-骨髓间充质干细胞、人绒毛膜促性腺激素-骨髓间充质干细胞或所有三种人绒毛膜促性腺激素-骨髓间充质干细胞(图1g)。这些结果表明hLD-SCs具有免疫抑制作用,这是间充质干细胞的重要生理功能。
3.2.改良的两步肝分化方案从hLD-SCs产生肝细胞样细胞
以前的一项研究报道了一种两步方法,用化合物,包括HGF,碱性成纤维细胞生长因子和烟酰胺,将骨髓间充质干细胞分化为肝细胞样细胞19].在目前的研究中,我们测试了几种不同化学物质的混合物,并通过添加法舒地尔(RhoA/ROCK信号抑制剂)和5-氮杂胞苷(DNMT抑制剂)来提高分化能力,从而修改了以前的两步肝细胞分化方案(图2a)。为了测量我们的分化方案的适用性,跟踪了细胞的形态学变化。在第一步分化过程中,形态学变化不明显。然而,在改用第二步鸡尾酒后7天,细胞开始变得更圆。在步骤2培养基中维持细胞7天以上后,细胞显示出向肝细胞样形态的强烈变化(图2b)。
3.3.肝谱系发育过程中基因表达模式的比较
由于我们的两步体外分化方案显示了干细胞的肝细胞样形态学变化,我们在分化过程中使用分子动力学来跟踪这些变化。众所周知,干细胞经历了向肝细胞样细胞的阶段性分化,即从多能细胞分化为最终的内胚层、肝祖细胞,最后是成熟的肝细胞样细胞49,50].目前的研究跟踪了肝谱系发育期间代表性阶段指示基因的变化(图3a)。
由于我们可以观察到细胞形态的明显变化,我们接下来分析了作为肝细胞成熟标志的人白蛋白的抗体表达。白蛋白的蛋白表达在第7天不明显。然而,细胞在第14天开始表达白蛋白,并且这种表达增加到第21天(图3b)。
对于基因表达分析,将分期肝分化相关基因的表达值与原代人肝细胞的表达水平进行比较。首先,测量三个内胚层阶段标记(图3c)。有趣的是,hLD-SCs表达高水平的GATA4,内胚层发育的一个重要基因。的基础表达水平GATA4在hLD-SCs中的表达水平高于PHH地区,尽管GATA4在肝分化过程中,hLD-SCs的表达降低。叉头盒蛋白A1(FOXA1)在hLD-SCs的干细胞阶段表达相对较高,但这种差异在第7天消失。FOXA2在第0天,人骨髓间充质干细胞和人骨髓间充质干细胞的表达没有差异,但在第14天,人骨髓间充质干细胞的表达显著增加。然而,表达水平FOXA2与第0天相比,第14天的hLD-SCs相对较高,但差异不显著(图3c)。值得注意的是,所有分化的人骨髓间充质干细胞和人骨髓间充质干细胞不能达到的表达水平FOXA1和FOXA2在肝分化过程中。考虑到已有报道称PHHs在胚胎发育和成年期自然表达FOXA1/2,[51],这可能是由于天然产生的肝细胞和体外分化的肝细胞样细胞之间的差异造成的。
目前,肝祖细胞是[最广泛接受的治疗肝病的有希望的再生来源52].因此,我们相应地测量了肝祖细胞相关基因[的表达50].羧肽酶M(每千成本(cost per mille))已知在胚胎肝祖细胞[中高度表达53].CD133据报道主要在癌症干细胞中表达[54],但也被广泛接受为肝祖细胞标记物[55].肝祖细胞标记物,每千成本(cost per mille)和CD133,在第14天在hLD-SCs中显著增加,但在hUC-MSCs中不显著增加(图3d)。然而,hUC-MSCs和hLD-SCs不表达上皮细胞粘附分子(分子)在肝分化期间(补充数字S2A).分子已被报道为肝祖细胞的标志,同时已知其在细胞增殖和分化中具有多种作用[56],但成熟肝细胞不表达分子[57].此外,最近的一项研究报告称分子表达可抑制体外[肝成熟58].在以下细胞角蛋白19的测量中(CK19),这是肝祖细胞和胆管分化的指示性标志,只有未分化的hUM-MSCs表达相对较高CK19,在分化过程中减少(补充图S2B).这一观察结果与以前的报告一致,以前的报告指出未分化的人脐带间充质干细胞可以表达CK19[扩张期间18]而hLD-SCs不表达CK19[32].另一种已知的肝祖细胞标记物,SRY相关的HMG盒转录因子9(SOX9),在所有hUC-MSCs和两个hLD-SCs的分化的第14天增加,而hLD-SC 1细胞达到其最高水平。的表达SOX9在第21天hLD-SC 1和hLD-SC 2细胞中迅速减少,但是在第21天hUC-MSC细胞保持在升高的水平(补充数字S2C).SOX9是广泛接受的胆管细胞分化标志。然而,SOX9-表达细胞被认为在激活肝祖细胞成熟为肝细胞[中起重要作用59].对这些结果进行综合解释后,分子和CK19可能对当前的体外肝分化结果影响不大每千成本(cost per mille),CD133,和SOX9可以作为hLD-SCs肝分化的指示标记。
肝细胞成熟标记物在分化过程中逐渐增加图3e)。对于HNF1A和细胞色素P450 1A2(CYP1A2),尽管hLD-SCs在分化过程中持续上升,但hUC-MSCs的表达最高。对于HNF4A,hLD-SCs在第14天表达增加,这种趋势在hUC-MSCs中不存在。对于甲胎蛋白(法新社(Agence France Presse)),白圣职衣、和细胞色素P450 3A4(CYP3A4),hLD-SC 1细胞在分化过程中表现出与hUC-MSCs相似的表达模式。然而,CYP3A4肝分化过程中hLD-SC 2细胞的数量没有增加。
总的来说,hLD-SCs具有肝源性潜能,内胚层标记物基础表达高,GATA4和FOXA1。两步肝脏分化似乎在第14天成熟中期,肝脏祖细胞相关基因水平较高,每千成本(cost per mille)和CD133。肝分化期间,hLD-SCs显示肝细胞成熟相关标志物持续升高。然而,至少在体外,hLD-SCs与hUC-MSCs相比,在肝脏成熟方面没有优势。
3.4.线粒体耗氧率和代谢谱比较
由于分化过程需要高能量消耗,最近的研究表明线粒体功能在分化过程中很重要,如成骨分化[60]和脂肪生成[61].光学字符识别是一种通过线粒体氧化磷酸化来测量三磷酸腺苷产量的有效方法。因此,我们比较了两步肝分化过程中的线粒体光学字符识别。对于hUC-MSCs和两个hLD-SCs,在分化的第7天OCR增加。就代谢谱而言,最大呼吸和备用呼吸能力在分化的第7天显著增加(图4a)。在分化的第0天,hUC-MSCs和两个hLD-SCs具有相似的光学字符识别率。在两个hLD-SCs中,基础呼吸和ATP产量稍低。然而,在分化的第7天和第14天,两个hLD-SCs的光合作用,尤其是最大呼吸作用相对较高(图4b)。综上所述,这些结果表明,当hUC-MSCs和hLD-SCs未分化时,线粒体功能相似,但当细胞经历肝分化时,hLD-SCs往往表现出更有利的能量状态。由于我们补充了两种小分子,法舒地尔和5-氮杂胞苷,以增加前7天的分化稳定性,这可能是分化第7天光学字符识别率增加的原因。然而,hLD-SCs中OCR的增加似乎与肝分化结果无关,特别是考虑到大多数肝细胞成熟标记物(HFN1A,法新社(Agence France Presse)、和CYP家族基因)在分化诱导的hLD-SCs中相对较低。
3.5.肝缺血-再灌注损伤期间肝干细胞的转运(LIRI)
众所周知,间充质干细胞通过其营养性质引起肝脏再生,并能保护肝脏免受损伤[17].除了这些因素外,据报道外源性间充质干细胞可转移至损伤器官[62].由于我们的体外研究显示hLD-SCs具有类似于MSC的特征,我们想知道在体内还能观察到什么特征。为了测量细胞转运事件,小鼠暴露于肝脏缺血45分钟,然后通过尾静脉静脉注射每种类型的hUC-MSC或hLD-SCs,然后再灌注6小时(图5a)。与未治疗的LIRI组相比,用人骨髓间充质干细胞或两种人骨髓间充质干细胞治疗的小鼠血清谷草转氨酶和谷丙转氨酶水平较低(图5b)。由于细胞用DiR荧光染料标记,我们可以使用IVIS光谱成像系统测量细胞的运输。通过尾静脉将细胞注射到小鼠体内后,hUC-MSCs比hLD-SCs更早沉降。人脐带间充质干细胞的荧光信号密度较高。这可能是因为hUC-MSCs和hLD-SCs的大小不同。腹部切开和组织提取的代表性图像显示,通过尾静脉注射的干细胞在6 h后被输送到肝脏(图5c)。组织学也显示了一致的结果,例如人骨髓间充质干细胞和两种人骨髓间充质干细胞具有相似的降低LIRI效应(图5d,E)。炎症细胞因子的基因水平,肿瘤坏死因子,Il1b,Il6,和Il10在未移植的LIRI组中均显著增加,而干细胞治疗显著减弱了这种增加(图5f)。
3.6.分化诱导的hLD-SCs的自发分化和再生潜能
我们以前的体外研究表明hLD-SCs与hUC-MSCs具有不同的特征,具有高的基础内胚层标记表达(GATA4和FOXA1)和高肝祖细胞相关基因表达(每千成本(cost per mille)和CD133),尽管没有认识到肝细胞成熟相关标志物的优势。基于这些观察,我们想知道hLD-SCs在体外分化的不同阶段转移到体内环境后是否显示出不同的结果。为了观察hLD-SCs的体内反应,免疫缺陷型NRG小鼠用肝毒性TAA治疗两次,共治疗5天,然后通过脾内途径移植hUC-MSCs或hLD-SCs。让小鼠恢复14天(图6a)。
第5天的小鼠表现出大范围的坏死细胞死亡,并表现出典型的肝衰竭症状,但大多数在14天后恢复(补充图S3A).血清谷草转氨酶和谷丙转氨酶的升高在第14天也恢复了(补充图S3B).在移植小鼠的人骨髓间充质干细胞或人骨髓间充质干细胞中观察到相同的结果(补充图S3C)血清谷草转氨酶和谷丙转氨酶无明显变化(补充图S3D).
我们可以通过测量人类特异性线粒体DNA (mtDNA)和基因组DNA (gDNA)扩增子(图6b)。移植肝分化诱导细胞的小鼠肝脏中mtDNA和胶质细胞源性神经营养因子的相对含量显著高于未分化干细胞(图6c)。正如我们之前的体内模型所显示的,当损伤发生时,hUC-MSCs和hLD-SCs转运到肝脏中,人gDNA和mtDNA在受损肝脏中的存在是相当合理的。
为了测量肝脏中是否发生自发分化和成熟为功能性肝细胞,使用人类细胞特异性细胞质标记物STEM121检测人类细胞,并使用IHC检测人类白蛋白(hALB)作为人类肝细胞标记物。在所有进行细胞移植的小鼠中观察到人细胞和表达hALB的细胞(图6d和补充图S4A).我们发现并非所有残留在小鼠肝脏中的人类细胞都表达hALB(图6e和补充数字S4B).在hUC-MSCs和hLD-SC 1移植的小鼠中,14天的分化细胞显示出葡萄状的hALB阳性区域的高级成熟。特别是,14天分化的hLD-SC 1细胞、人细胞质标记阳性细胞和hALB阳性细胞大多位于肝内胆管(也称为海林管)附近。在hLD-SC 2细胞移植的小鼠中,在导管区域周围观察到细胞质标记阳性细胞,但是与hLD-SC 1细胞相比,观察到较少数量的hALB阳性细胞。由于hLD-SC 2细胞的体外肝分化表现出相对较小的变化,尤其是在肝细胞成熟相关标记物方面,这些体内结果相当一致。
综合考虑结果,hLD-SCs似乎对肝脏友好,这使得它们能够更好地适应体内环境。虽然hLD-SCs的体外分化在肝细胞成熟相关标记物的产生方面是不完全的,但当移植到体外环境中时,它们自发分化为成熟肝细胞。值得注意的是,当体内细胞移植与体外肝分化相结合时,hLD-SCs比hUC-MSCs产生成熟肝细胞的速度更快。
4.讨论
hLD-SCs被评估为肝脏再生治疗的可能来源。然而,问题仍然是来自肝脏的成体干细胞是否能比其他干细胞更好地向肝谱系分化。在目前的研究中,我们通过比较与分期肝分化相关的基因和代表线粒体呼吸的OCR,直接比较了肝分化过程中hLD-SCs和其他类型成体干细胞的差异。最后,我们将肝分化诱导的hLD-SCs移植到两种不同的肝损伤小鼠模型中。
我们从三个不同的肝脏捐献者中分离出了hLD-SCs,使用的方法与Herrera [先前报道的方法相似29]和纳吉米·[30].像hBM-MSCs或hUM-MSCs一样,我们研究中分离的hLD-SCs对MSCs标记物(CD90和CD105)呈阳性,而对造血干细胞标记物CD34呈阴性,并明确表达多能性标记物。OCT4,NANOG,和SOX2。这些结果与霍洛登科·[以前的研究一致35].就免疫调节而言,hLD-SCs还通过抑制异基因淋巴细胞反应中的T细胞增殖表现出免疫抑制特性。由于已知骨髓间充质干细胞表达的细胞因子在细胞移植后与常驻细胞相互作用,我们还比较了代表性细胞因子的表达,如肿瘤坏死因子α,IL1β,IL6,IL10,和转化生长因子β1。然而,每种细胞类型的表达状态不同,因此,很难定义一个独特的特征。这种差异似乎是由捐赠者的差异造成的,因为每个捐赠者的年龄、性别和生理状态都不同。在目前的研究中,我们可以比较来自21岁男性(hLD-SC 1)和38岁女性(hLD-SC 2)肝脏的两种不同hLD-SC的体内和体外反应。尽管多能性标记(OCT4,NANOG,和SOX2)在hLD-SC 2中高表达,hLD-SC 1细胞的体外和体内分化结果较好。由于我们不了解哪些特征归因于不同的结果,需要进一步研究供体特征和获得的hLD-SCs之间的联系。
我们的一个主要问题是基于一个被广泛接受的假设,即来自特定器官的间充质干细胞是否更适合在同一器官中进行组织修复和再生,因为它们可能已经习惯了[的先天微环境35].目前的研究试图调查hLD-SCs是否比其他来源的MSCs更有可能分化为肝细胞样细胞,如果是,是否存在任何关键特征。干细胞体外分化为肝细胞样细胞遵循改良的两步分化方案[19].步骤1培养基补充有两种小分子;RhoA/ROCK信号抑制剂法舒地尔和DNMT抑制剂5-氮杂胞苷。据报道,法舒地尔可抑制干细胞的细胞周期停滞和凋亡,因此被广泛用于维持各种类型的干细胞[63,64,65].此前已经观察到,5-氮胞苷治疗可抑制骨髓间充质干细胞中的整体脱氧核糖核酸甲基化,这有助于诱导肝细胞特异性基因表达[66].虽然我们不能用小分子比较常规分化方案和改良方案之间的差异,但我们观察到我们改良的两步肝分化方案可以将hUC-MSCs和hLD-SCs分化为肝细胞样细胞。我们不能平行比较这两种方案,因为没有法舒地尔和5-氮胞苷的细胞产生的结果不一致,肝分化有缺陷,不适合当前的研究。因此,我们可以得出结论,两步肝分化方案结合小分子有利于肝分化。
我们发现hLD-SCs表达更高水平的。GATA4贯穿肝细胞分化的所有阶段。如同GATA4据报道对干细胞内胚层的形成很重要[67】,的高表达GATA4在hLD-SCs中表明内胚层潜能很高。FOXA1和FOXA2是已知的内胚层特异性标记物[68].的基础表达水平FOXA1在hLD-SCs中高,而hLD-SCs和hUC-MSCs显示相似水平的。FOXA1在第七天。基于这些发现,我们得出结论,hLD-SCs比hUC-MSCs具有更内胚层样的特征。
hLD-SCs肝细胞分化过程中一个有趣的变化是第14天肝祖细胞标记物显著增加。肝星状细胞阳性表达CD133据报道是肝祖细胞[69].此外,每千成本(cost per mille)据报道是人iPSC衍生的肝祖细胞的有用表面标记物[53].这两个标记显著(P%3C 0.001)在分化的第14天在hLD-SCs中增加,但在hUC-MSCs中不变。我们还测量了其他已知肝祖细胞标志物的表达,分子,CK19,和SOX9。然而,分子和CK19在分化期间保持在非常低的水平。因此,基于分子和CK19表达,我们体外分化hUC-MSCs和hLD-SCs可能是独立发生的。然而,SOX9在分化的第14天升高,在第21天降低,显示与以前的报告一致[70].hLD-SCs也显示肝细胞成熟相关因子的增加(HNF1A,HNF4A,和法新社(Agence France Presse))分化的第14天,但是与hUC-MSCs相比没有观察到进一步的优势。基于这些发现,我们得出结论,在分化的第14天,hLD-SCs变为肝祖细胞样状态。
有趣的是,我们发现第7天分化细胞的OCR达到了最高水平,甚至在hLD-SCs中也是如此。先前的一项研究报告称,在肝脏成熟过程中,光学字符识别率会上升;然而,细胞的内胚层样和肝祖细胞样状态并没有导致光合作用的显著增加[71].在我们的研究中,我们比较了肝分化的第0、7和14天,但没有比较具有成熟肝细胞样状态的第21天分化的细胞。然而,第7天分化的人骨髓间充质干细胞和人骨髓间充质干细胞的光学字符识别率显著增加。这可能是因为补充了小分子。去除小分子后,增加的光学字符识别率在第14天下降。
我们还关注了分化过程中的线粒体呼吸。在干细胞分化过程中,线粒体活性的功能变化已被广泛研究72].例如,在人类胚胎干细胞的神经分化过程中,观察到三磷酸腺苷需求和线粒体活性的减少[73].在骨髓间充质干细胞中,已经研究了线粒体在成骨、成脂和成软骨分化中的作用74].能量代谢对于干细胞的维持和分化很重要,因为在分化为体细胞的过程中,氧化磷的比率趋于增加[75].在胚胎干细胞的肝分化中,据报道,在肝细胞成熟过程中,光学字符识别率趋于升高,并且光学字符识别率在晚期肝细胞中最高[76].我们的研究比较了肝分化过程中的第0、7和14天,OCR,尤其是最大呼吸和备用呼吸能力,在所有hUC-MSCs和hLD-SCs的第7天分化细胞中显著升高。这些结果表明,在分化的第7天,诱导的干细胞可能具有高分化潜能,这使得随后的肝分化过程成为可能。
在目前的研究中,我们还使用了两种不同的肝损伤体内模型。在暴露于LIRI的小鼠中,人骨髓间充质干细胞和人骨髓间充质干细胞在2小时内被运输到受伤的肝脏并抑制肝损伤。正如以前的研究表明,低剂量肿瘤坏死因子α可保护肝脏免受缺血/再灌注损伤[77,78],hUC-MSCs和hLD-SCs中表达的细胞因子可能有助于肝脏抑制进一步的应激。最近的报告显示,hLD-SCs还可以抑制肝星状细胞的活化,这意味着防止肝硬化的发展[79].hLD-SCs似乎可以作为缓解急性肝损伤的治疗来源。
TAA诱导的急性肝衰竭模型显示肝内长期植入hLD-SCs。TAA五天的治疗用于诱导暴发性肝衰竭。由于NRG小鼠在TAA标准浓度(200-400毫克/千克)下往往表现出更严重的反应,导致早期死亡,我们将TAA浓度调整为80毫克/千克,给药从每天一次减少到每两天一次。这种改造成功地帮助小鼠在干细胞移植后存活了14天。之前的一项研究证明了在移植后第7、30和60天用hLD-SCs处理的肝切除术小鼠模型中的人类细胞转运[80].与之前的研究相比,只有14天分化的hLD-SCs显示出与肝脏中维持60天的幼稚hLD-SCs相似的hALB区域。此外,14天分化的hLD-SCs被运输到肝内胆管附近,产生肝祖细胞。这表明分化的hLD-SCs和肝祖细胞的微环境相似。总之,肝分化诱导的hLD-SCs可以在肝脏内沉淀并自发成熟为产生白蛋白的肝细胞。
我们研究的优势是细胞的相对容易处理和成本有效的维护,简单稳定的分化方案,以及细胞移植后肝脏自发分化为成熟肝细胞的体内结果。然而,由于我们研究中使用的肝脏来自健康活体肝移植供体,我们无法分析来自患病肝脏或已故供体肝脏的hLD-SCs。由于我们未能从hLD-SCs的供体特异性特征中注释出特定的关系,需要进一步的研究来比较从不同状态的肝脏中分离出的不同hLD-SCs。此外,我们可以观察到分离的肝细胞和体外分化的肝细胞样细胞之间的许多差异。各种研究表明,多能细胞衍生的肝细胞样细胞和自然分化的肝细胞之间存在转录组差异71],比较整个转录组或蛋白质组以辨别培养细胞和分离细胞的差异将是有趣的。
总之,我们假设来源于肝脏的干细胞比其他组织来源的骨髓间充质干细胞具有更好的肝分化能力,并使用我们改进的两步肝分化方案比较了hUC-MSCs和hLD-SCs之间的肝细胞分化效果。为了支持这一假设,hLD-SCs具有高基础表达的特征。GATA4和FOXA1、内胚层命运相关基因和分化第7天和第14天较高的线粒体呼吸,这表明高能量潜能以及肝祖细胞标记物的高表达(每千成本(cost per mille)和CD133)在体外分化的第14天。然而,与分化的hUC-MSCs相比,获得成熟的肝细胞样细胞没有进一步的优势。然而,在体内环境中,hLD-SCs可以在受损肝脏内运输和沉积,并自发分化为表达hALB的成熟肝细胞。总的来说,我们认为hLD-SCs具有更好的肝源性潜力,可能是再生医学的一个有前途的来源(图7).
5.结论
hLD-SCs是从人肝组织中获得的间充质样干细胞,具有更好的肝源性分化能力,内胚层标记物的基础水平高,分化第14天肝祖细胞相关基因表达增加,并且在肝分化过程中线粒体呼吸作用增强。体内细胞移植显示,肝分化诱导的hLD-SCs可进入小鼠损伤的肝脏,并自发分化为肝细胞样细胞,提示肝脏具有再生潜能。体外分化和体内细胞移植的结合可能为人类肝脏来源的间充质样干细胞再生治疗提供有前景的方法。
补充材料
以下内容可在网上获得https://www.mdpi.com/2073-4409/9/6/1521/s1,图S1:CD34阳性细胞的流式细胞术直方图,图S2:相对标准化表达分子,CK19,和SOX9,图S3:硫代乙酰胺(TAA)诱导的急性肝损伤大多在14天内恢复,图S4:硫代乙酰胺(TAA)诱导的急性肝损伤小鼠中肝细胞自发分化和hLD-SC 2成熟的观察,表S1:引物详情分子,CK19,和SOX9。
作者贡献
概念化,E.K .,E.T数据管理,法学博士和法学博士;形式分析;为收购、通用汽车、英国电气和电子技术公司提供资金;调查,法学会和法学会;方法论,法学博士、法学硕士、理学硕士、理学硕士和理学硕士;项目管理、E.K .和E.Tresources,R.L .,y-I . y .,V.A.K .,g-w . s .,S.H .,s-g . l;软件、J.L .、J.C .、S.K监督,通用汽车公司和通用汽车公司;验证,J.L .,和J.C可视化,法学博士和法学博士;写作——初稿,法学博士;写作——审核和编辑,J.C .,E.K .,和E.T .所有作者都已阅读并同意手稿的出版版本。
资金
本研究由峨山生命科学研究所资助,主要资助项目有德EY 17-662、德EY 18-662和康2019-755;韩国国家研究基金会,批准号NRF-2015 k1 a4 a 3046807;授权号NRF-2017 r1d1a 1b 04032429;和大韩民国卫生福利部,批准号为HI15C0972。
感谢
作者们对现代金和朴智星的技术服务表示感谢。我们还感谢会聚医学研究中心(CREDIT)的流式细胞术核心、光学成像核心、动物研究核心实验室和比较病理学核心以及阿桑医学中心的核心设施使用了他们共享的设备、服务和专业知识。
利益冲突
作者声明没有利益冲突。
引用
- 肝移植:肝脏替代的现状和新方法。胃肠病学 2001,120, 749–762.[谷歌学者] [交叉引用] [PubMed]
- Moon,D.B肝脏移植。肠肝 2009,3, 145–165.[谷歌学者] [交叉引用] [PubMed]
- Lantieri,l;格林伯特,p;OrtonneSuberbielle,c;鲍里斯,d;吉尔·韦尔内;莱莫涅,c;Bellivier,f;Lefaucheur,J.P谢弗,n;面部移植:一项前瞻性开放研究的长期随访和结果。柳叶刀 2016,388, 1398–1407.[谷歌学者] [交叉引用]
- Burra,p;Tomat,s;别墅,e;Gasbarrini,a;哥斯达黎加,美国;m . t . conconni;福布斯,S.JFarinati,f;科兹,e;艾莉森,M.R应用于干细胞的实验肝病学。挖。肝Dis。 2008,40, 54–61.[谷歌学者] [交叉引用] [PubMed]
- 田中,k;索托-古铁雷斯,a;纳瓦罗-阿尔瓦雷斯,n;里瓦斯-卡里略,法学博士;君,H.S功能性肝细胞培养及其在细胞疗法中的应用。细胞移植。 2006,15, 855–864.[谷歌学者] [交叉引用]
- 胚胎干细胞的潜力:一个伦理问题,即使有替代的干细胞来源。J.Med。Eth。 2006,32, 665–671.[谷歌学者] [交叉引用]
- 于,y;王,x;诱导多能干细胞在肝病治疗中的潜力和挑战。J.Clin。Med。 2014,3, 997–1017.[谷歌学者] [交叉引用]
- 梅里尔斯,法学博士;Chagastelles,P.C纳尔迪,新罕布什尔州。间充质干细胞存在于几乎所有的产后器官和组织中。J.细胞Sci。 2006,119, 2204–2213.[谷歌学者] [交叉引用]
- 蔡,C.C多能性转录因子在间充质干细胞中的功能作用。细胞周期 2012,11, 3711–3712.[谷歌学者] [交叉引用]
- Aggarwal,s;人类间充质干细胞调节同种异体免疫细胞反应。血 2005,105, 1815–1822.[谷歌学者] [交叉引用]
- 郭,T.KHo,J.H间充质干细胞治疗非肌肉骨骼疾病:新兴应用。细胞移植。 2009,18, 1013–1028.[谷歌学者] [交叉引用]
- m . f . pittenger;麦凯,上午;Beck,S.CJaiswal,R.Kr .道格拉斯;Mosca,J.D莫尔曼,文学硕士;Simonetti,D.W克雷格,s;马尔夏克,成年人骨髓间充质干细胞的多向分化潜能。科学 1999,284, 143–147.[谷歌学者] [交叉引用]
- 傅,x;刘,g;Halim,a;居,y;罗问;间充质干细胞迁移和组织修复。细胞 2019, 8.[谷歌学者] [交叉引用]
- Burra,p;Tomat,s;Bizzaro,d;佩里加诺,d;Masier,a;m . t . conconni;Russo,f;Bo,p;肝病学中的干细胞。挖。肝Dis。 2008,40, 54–61.[谷歌学者] [交叉引用] [PubMed]
- 范·波尔;Parekkadan,b;Cho,C.HBerthiaume,f;纽约州纳米亚斯市;Tilles,A.W间充质干细胞衍生的分子在体外和体内直接调节肝细胞的死亡和再生。肝脏病学 2008,47, 1634–1643.[谷歌学者] [交叉引用] [PubMed]
- 王,Y.H吴博士;陈,b;陈,E.Q唐,海。骨髓间充质干细胞治疗急性肝衰竭的研究进展。干细胞研究。2018,9, 227.[谷歌学者] [交叉引用] [PubMed]
- 弗朗索瓦斯;Mouiseddine,m;Allenet-Lepage,b;沃斯温克尔,j;Douay,l;Benderitter,m;人类间充质干细胞通过抗氧化过程、血管保护、肝细胞分化和营养效应提供对辐射诱导的肝损伤的保护。生物医学研究。2013,2013, 151679.[谷歌学者] [交叉引用] [PubMed]
- Campard,d;Lysy,P.A纳吉米,m;天然脐带基质干细胞表达肝标志物并分化为肝细胞样细胞。胃肠病学2008,134, 833–848.[谷歌学者] [交叉引用]
- Lee,K.D郭,T.K黄鹏,j;钟永福;林,C.T小周,S.H陈,J.R陈,Y.P人骨髓间充质干细胞的体外肝分化。肝脏病学 2004,40, 1275–1284.[谷歌学者] [交叉引用] [PubMed]
- 张,y;李,y;张;李,j;间充质干细胞在肝硬化治疗中的潜在应用。干细胞研究。 2018,9, 59.[谷歌学者] [交叉引用]
- 谭,E.KShuh,m;弗朗索瓦-沃恩;J.A .桑德斯;缺血再灌注损伤后可忽略的卵圆细胞增殖,有无肝部分切除术。Ochsner J . 2017,17, 31–37.[谷歌学者] [PubMed]
- 肝脏再生和修复:肝细胞、祖细胞和干细胞。肝脏病学 2004,39, 1477–1487.[谷歌学者] [交叉引用] [PubMed]
- Shupe,T.D皮斯卡利亚,公元前;哦,S.HGasbarrini,a;从大鼠肝脏中分离和鉴定肝干细胞,或称“卵圆细胞”。方法Mol。Biol。 2009,482, 387–405.[谷歌学者] [交叉引用] [PubMed]
- 李,j;辛,j;张;吴,j;蒋,l;周,问;李,j;郭,j;曹,h;人肝祖细胞表达造血细胞标志物CD45和CD109。里面的J. Med。Sci。 2014,11, 65–79.[谷歌学者] [交叉引用] [PubMed]
- 金,y;康,k;李,S.BSeo,d;Yoon,s;Kim,S.JJang,k;Jung,Y.KLee,K.G因子,V.M小分子介导的人肝细胞重编程为双能祖细胞。J.肝。 2019,70, 97–107.[谷歌学者] [交叉引用]
- 谢,B.Q孙,d;杜,Y.Y贾,j;孙,S.C徐,j;刘,杨芳;项,C.G陈,科技;谢,H.F一种两步谱系重编程策略,用于从成纤维细胞产生具有功能活性的人肝细胞。单元格分辨率 2019,29, 696–710.[谷歌学者] [交叉引用]
- 张,k;张;刘,w;马,x;Cen,j;孙,z;王,c;冯;张,z;岳,l;具有高效肝再生能力的原代人肝细胞的体外扩增。细胞干细胞 2018,23, 806–819.[谷歌学者] [交叉引用]
- 李,x;刘,博士;Y.T .马;杜,X.MJing,J.Z王,法学博士;谢,B.Q孙,d;孙,S.Q金,xq;通过化学诱导的XEN样状态对成纤维细胞进行直接重编程。细胞干细胞 2017,21, 264–273.[谷歌学者] [交叉引用]
- Herrera,文学硕士;布鲁诺,s;Buttiglieri,s;Tetta,c;加蒂;Deregibus,M.CBussolati,b;成人肝脏干细胞群的分离和鉴定。干细胞 2006,24, 2840–2850.[谷歌学者] [交叉引用]
- 纳吉米,m;Khuu,D.NLysy,P.AJazouli,n;Abarca,j;Sempoux,c;成人来源的人肝脏间充质样细胞作为肝细胞的潜在祖细胞库?细胞移植。 2007,16, 717–728.[谷歌学者] [交叉引用]
- 潘,Q.WFouraschen,s . m . g;Kaya,f . s . f . a;Verstegen,M.MPescatori,m;斯塔布斯,A.Pvan IJcken,w;范德斯洛特,a;斯密茨,r;Kwekkeboom,j;从人肝移植物中动员肝间充质干细胞。肝移植。2011,17, 596–609.[谷歌学者] [交叉引用] [PubMed]
- Lee,J.H朴槿惠,H.J金,Y.A李博士;Noh,J.KKwon,c . h . d;荣格,S.M来自成人死亡供肝的肝源干细胞的表型特征。移植。继续。 2012,44, 1110–1112.[谷歌学者] [交叉引用] [PubMed]
- 罗,X.B古普塔,k;Ananthanarayanan,a;王,Z.N .夏,l;李,上午;r . b . sak ban;刘,S.D .俞海平。成人肝源性间充质样干细胞向功能性肝细胞的定向分化。Sci。有代表性的 2018,8。[谷歌学者] [交叉引用] [PubMed]
- 王,y;于,x;陈,e;肝源性人间充质干细胞:肝病治疗的新来源。干细胞研究。 2016,七, 71.[谷歌学者] [交叉引用]
- Kholodenko,I.V库尔巴托夫,L.KKholodenko,R.VManukyan,G.V成人肝脏中的间充质干细胞:炒作还是希望?细胞 2019, 8.[谷歌学者] [交叉引用]
- 李,w;李,k;魏,w;干细胞生物学和治疗学的化学方法。细胞干细胞 2013,13, 270–283.[谷歌学者] [交叉引用]
- 宋,h;昌,w;宋,B.W小分子对间充质干细胞的特异性分化。Am。干细胞 2012,一, 22–30.[谷歌学者]
- Korostylev,a;Mahaddalkar,P.UKeminer,o;哈甸,k;Schorpp,k;Gribbon,p;一个高含量的小分子筛选确定了新的最终内胚层的诱导剂。Mol。梅塔。 2017,6, 640–650.[谷歌学者] [交叉引用]
- 所以,s;Lee,y;Choi,j;康,s;Lee,J.YHwang,j;Shin,j;J.R .达顿;Seo,E.J李,B.HRho相关激酶抑制剂法舒地尔可以替代Y-27632用于人类多能干细胞研究。公共科学图书馆 2020,15,e0233057。[谷歌学者] [交叉引用]
- 何,y;崔,j;他,t;Bi,y . 5-氮胞苷促进肝祖细胞的终末分化。Mol。Med。有代表性的 2015,12, 2872–2878.[谷歌学者] [交叉引用]
- Kim,j;飘,y;Pak,Y.K钟,d;韩,Y.M洪,J.S君,E.JShim,j-y;Choi,j;受妊娠期糖尿病影响的脐带间充质基质细胞显示早衰和线粒体功能障碍。干细胞开发。 2014,24, 575–586.[谷歌学者] [交叉引用]
- Kim,h;杨,g;Park,j;Choi,j;康,e;人脐带间充质干细胞在兔颞下颌关节骨关节炎模型中的治疗作用。Sci。有代表性的 2019,9, 1–14.[谷歌学者] [交叉引用] [PubMed]
- 公园,b-w;康,e-j;Byun,j .-h;儿子,m-g;Kim,h .-j;哈哈,y-s;Kim,t-h;Mohana Kumar,b;Ock,s .-a;来源于皮肤、骨髓和牙囊组织的人骨髓间充质干细胞的体外和体内成骨作用。分化 2012,83, 249–259.[谷歌学者] [交叉引用] [PubMed]
- 康,E.J王,X.J蒂普纳-赫奇斯;马,h;福尔梅斯,华盛顿特区;新墨西哥州古铁雷斯;Lee,Y.M凡·戴肯,c;艾哈迈德,r;李,y;成人来源的人iPSCs中体细胞线粒体基因突变的年龄相关积累。细胞干细胞 2016,18, 625–636.[谷歌学者] [交叉引用] [PubMed]
- 铃木,s;托莱多-佩雷拉市;罗德里格斯,F.J中性粒细胞浸润是肝脏缺血再灌注损伤的重要因素。移植 1993,55, 1265–1271.[谷歌学者]
- Kyurkchiev,d;Bochev,I;Ivanova-Todorova,e;MourdjevaOreshkova,t;Belemezova,k;间充质干细胞分泌免疫调节细胞因子。世界干细胞杂志 2014,6, 552–570.[谷歌学者] [交叉引用]
- 克莱因,S.L免疫反应的性别差异。纳特。免疫牧师。 2016,16, 626–638.[谷歌学者] [交叉引用]
- Bloom,D.D森坦尼,J.M北巴蒂亚;埃姆勒,C.A催干剂,d;Leverson,G.E小D.H .麦肯纳;啧啧,A.P林德布莱德,r;Hei,D.J一种测量间充质基质细胞介导的T细胞抑制的可重复免疫效能测定。细胞疗法 2015,17, 140–151.[谷歌学者] [交叉引用]
- m seguer-Ripolles,j;Khetani,S.RBlanco,J.GIredale,m;多能干细胞衍生的人类组织:评估药物代谢和安全性的平台。AAPS·j 2018,20, 20.[谷歌学者] [交叉引用]
- Chaudhari,p;田;Deshmukh,a;人类肝脏发育细胞模型中肝祖细胞标记物的表达动力学概述肝细胞和胆管细胞的命运承诺。Exp。Biol。Med。 2016,241, 1653–1662.[谷歌学者] [交叉引用]
- 刘氏,H.HNg,n . h . j;Loo,l . s . w;j . b . jasmen;肝细胞核因子的分子功能——在肝脏内外。J.肝。2018,68, 1033–1048.[谷歌学者] [交叉引用] [PubMed]
- Tsuchiya,a;陆,王文英。肝干细胞:肝上皮的可塑性。世界胃肠病学杂志。 2019,25, 1037–1049.[谷歌学者] [交叉引用] [PubMed]
- 高瀚宇;Koui,y;铃木,k;小林,a;纽约州米乌拉市;e . y . Chen;田中,m;宫岛是一种有用的细胞表面标记物,用于分离来源于人类诱导多能干细胞的可膨胀双潜能肝祖细胞。干细胞代表 2015,5, 508–515.[谷歌学者] [交叉引用] [PubMed]
- Mizrak,d;布里坦,m;艾莉森,《分子生物学:当前的分子》。J.悲怆。 2008,214, 3–9.[谷歌学者] [交叉引用]
- 赵,D.X陈;蔡,j;郭,Y.S宋,Z.HChe,j;刘,c;吴,c;丁,M.X邓海康。人胚胎干细胞肝祖细胞的分离和鉴定。公共科学图书馆 2009,四,e6468。[谷歌学者] [交叉引用]
- Okabe,m;Tsukahara田中,m;铃木,k;Saito,s;KamiyaTsujimura中村,k;潜在的肝干细胞存在于正常和损伤小鼠肝脏的EpCAM+细胞中。发展 2009,136, 1951–1960.[谷歌学者] [交叉引用]
- 肝细胞及其祖细胞。J.肝。 2012,56, 490–492.[谷歌学者] [交叉引用]
- 唐,d;陈,y;傅,G.B袁,T.J黄;王,Z.Y李,W.J .焦,Y.F于,女;闫,黄海兴。EpCAM通过激活Notch1信号通路抑制体外人肝祖细胞向肝细胞的分化。生物化学。生物物理学。Res. Commun . 2020。[谷歌学者] [交叉引用]
- 古山,k;川口,y;秋山,h;堀口,m;儿玉,s;Kuhara细川护熙,s;Elbahrawy,a;Soeda,t;小泉,m;成人肝脏、外分泌胰腺和肠中表达Sox9的祖细胞区的连续细胞供应。纳特。杰特。 2011,43, 34–41.[谷歌学者] [交叉引用]
- 申,Y.L吴;秦,医学博士;夏,Y.K周,z;张,X.M炭黑抑制间充质干细胞的成骨作用:线粒体的作用。部分。纤维毒物。 2018,15, 16.[谷歌学者] [交叉引用]
- Forni,M.FPeloggia,j;特鲁多,k;Shirihai,o;鼠间充质干细胞对分化的承诺受线粒体动力学的调节。干细胞 2016,34, 743–755.[谷歌学者] [交叉引用] [PubMed]
- Ullah,m;刘博士;间充质基质细胞归巢:机制和改善策略。iScience 2019,15, 421–438.[谷歌学者] [交叉引用] [PubMed]
- ROCK激酶抑制的应用。柯。指点江山。Cell Biol。 2008,20, 242–248.[谷歌学者] [交叉引用] [PubMed]
- 丁,j;李,Q.Y于,J.Z王,x;孙,C.H卢,C.Z肖,法舒地尔,Rho激酶抑制剂,在小鼠缺氧/复氧损伤后驱动成年神经干细胞的动员。Mol。手机。神经症。 2010,43, 201–208.[谷歌学者] [交叉引用]
- Tsuno,a;Nasu,k;川野,y;Yuge,a;李,H.L .安倍,w;法舒地尔抑制人子宫内膜异位基质细胞的增殖和收缩,诱导细胞周期停滞和凋亡:一种治疗子宫内膜异位的有前途的药物。J.Clin。内分泌。梅塔。 2011,96,e 1944–e 1952。[谷歌学者] [交叉引用] [PubMed]
- 李,c-w;黄;黄博士;黄,杨永红;Ho,J.H杨,m-h;杨,V.W脱氧核糖核酸甲基转移酶调节间充质基质细胞的肝源性谱系可塑性。干细胞代表 2017,9, 247–263.[谷歌学者] [交叉引用]
- 费希尔,J.B普拉坎蒂,k;饶,s;邓肯,S.A. GATA6对人类多能干细胞形成内胚层至关重要。Biol。打开2017,6, 1084–1095.[谷歌学者] [交叉引用]
- 王,p;McKnight,K.D王博士;罗德里格斯,R.T杉山,t;顾,X.YGhodasara,a;屈,k;Chang,H.Y一个纯化的最终内胚层的分子标记指导从小鼠和人类胚胎干细胞中分化和分离内胚层。干细胞开发。 2012,21, 2273–2287.[谷歌学者] [交叉引用]
- Kordes,c;Sawitza,I;穆勒-马巴赫,a;北阿勒-阿加;凯特尔,v;Klonowski-Stumpe,h;肝星状细胞是祖细胞。生物化学。生物物理学。Res. Commun . 2007,352, 410–417.[谷歌学者] [交叉引用]
- 范·埃肯,p;Sciot,r;Callea,f;范德斯滕,k;莫尔曼,p;人类肝内胆管的发育:一项角蛋白免疫组织化学研究。肝脏病学 1988,8, 1586–1595.[谷歌学者] [交叉引用]
- Wruck,w;人类多能干细胞衍生的HLC转录组数据使肝发生的分子解剖成为可能。Sci。数据 2018,5, 180035.[谷歌学者] [交叉引用] [PubMed]
- Wanet,a;Arnould,t;纳吉米,m;勒纳尔,《连接线粒体、新陈代谢和干细胞命运》。干细胞开发。2015,24, 1957–1971.[谷歌学者] [交叉引用] [PubMed]
- m . j . Bir ket;奥尔,洛杉矶;a . a . geren cser;Madden,D.TVitelli,c;Swistowski,a;品牌,医学博士;人胚胎干细胞神经分化过程中ATP需求和线粒体活性的降低。J.细胞Sci。 2011,124, 348–358.[谷歌学者] [交叉引用]
- 李,Q.Q高,Z.W陈,y;线粒体在间充质干细胞成骨、成脂和成软骨分化中的作用。蛋白质细胞 2017,8, 439–445.[谷歌学者] [交叉引用] [PubMed]
- 胡,C.X范,L.X岑,P.P陈,电机;姜,Z.Y能量代谢在干细胞维持和分化中起关键作用。里面的J. Mol。Sci。2016,17, 253.[谷歌学者] [交叉引用] [PubMed]
- 霍普金森,文学学士;Desler,c;Kalisz,m;Vestentoft,P.S拉斯穆森,L.J人类胚胎干细胞沿肝谱系分化过程中的生物能变化。氧化。Med。手机。朗格夫。 2017,2017, 5080128.[谷歌学者] [交叉引用] [PubMed]
- 阿布-阿马拉,m;杨,S.YTapuria,n;富勒,b;戴维森,b;肝脏缺血/再灌注损伤:炎症网络中的过程——综述。肝移植。 2010,16, 1016–1032.[谷歌学者] [交叉引用]
- Teoh,n;勒克莱尔,我;佩纳,公元;低剂量肿瘤坏死因子-α对小鼠肝脏缺血再灌注损伤的保护作用:预处理的意义。肝脏病学 2003,37, 118–128.[谷歌学者] [交叉引用]
- 纳吉米,m;Berardis,s;埃尔凯迪,h;Rosseels,v;Evraerts,j;伦巴第,c;El Taghdouini,a;亨利埃特,p;van Grunsven,l;人类肝脏间充质干细胞/祖细胞抑制肝星状细胞活化:体外和体内评估。干细胞研究。2017,8, 131.[谷歌学者] [交叉引用]
- Khuu,D.N尼亚比,o;Maerckx,c;索卡尔,e;成年人肝间充质干细胞/祖细胞参与肝切除术后小鼠肝再生。细胞移植。 2013,22, 1369–1380.[谷歌学者] [交叉引用]
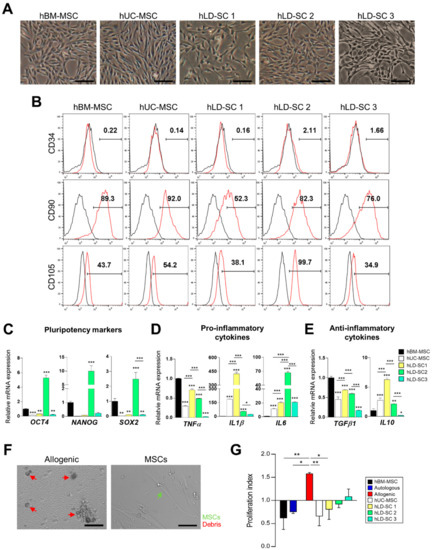
图1。人肝源性干细胞(hLD-SCs)和其他来源间充质基质/干细胞(MSCs)特性的比较。(A)从三个不同个体分离的人脐带基质衍生干细胞(hUC-MSCs)、人骨髓干细胞(hBM-MSCs)和人肝衍生干细胞(hLD-SCs)的显微成像。比例尺,200 μm(B)流式细胞术测量hUC-MSCs、hBM-MSCs和三个hLD-SCs。CD34被标记为造血干细胞标志物。CD90和CD105被标记为间充质干细胞标记。(C–E)的定量实时聚合酶链反应(qRT-PCR)分析(C)多能性标记(OCT4,NANOG,和SOX2), (D)促炎细胞因子(肿瘤坏死因子α,IL1β,和IL6),和(E)抗炎细胞因子(转化生长因子β1和IL10).基因表达水平标准化为磷酸甘油醛脱氢酶表达,并与hBM-MSCs的表达水平进行比较。数据表示为平均标准差。n = 4。(F)显微镜测量从两个不同志愿者分离的异基因外周血单核细胞(PBMCs)之间的相互作用过程,不含或含间充质基质细胞/干细胞(MSCs)。比例尺,100 μm(G)MLR测定时免疫细胞增殖的比较。比较了分别用hBM-MSCs、hUC-MSCs或三种hLD-SCs治疗后的自体、异体和异体反应。增殖指数通过将共培养96小时的细胞在450纳米波长下的吸光度除以处理前的细胞的吸光度来计算。P-值%3C 0.05被认为是显著的。n = 4,*,p% 3C 0.05;**,p% 3C 0.01;***,p%3C 0.001。
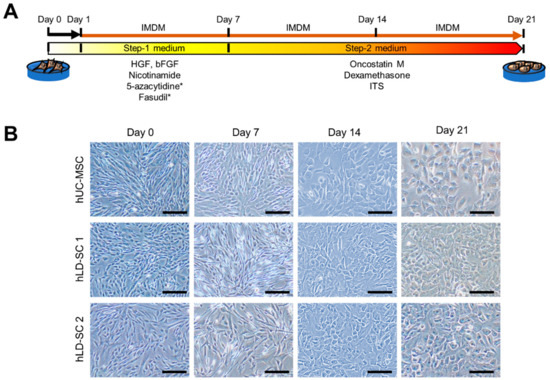
图2。干细胞的改良两步肝分化将hLD-SCs转变为肝细胞样形态。(A)诱导干细胞两步定向分化为肝细胞样细胞的方法的示意图。*,小分子。(B)两步肝分化过程中的显微测量。测量hUC-MSCs和两个hLD-SCs。显示肝分化第0、7、14和21天的细胞。比例尺,200 μm。
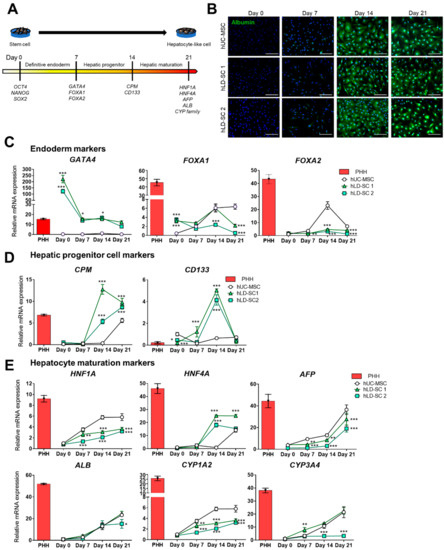
图3。干细胞向肝脏分化相关基因的表达。(A)干细胞向肝命运分化的示意图。描述了分化过程中的突出基因。(B)在分化的第0、7、14和21天对hUC-MSCs和两个hLD-SCs进行白蛋白免疫荧光染色。蓝色,DAPI;绿色,白蛋白。比例尺,200 μm。QrT-PCR测量(C)内胚层标记(GATA4,FOXA1,和FOXA2), (D)肝祖细胞标志物(每千成本(cost per mille)和CD133),和(E)肝细胞成熟标记(HNF1A,HNF4A,法新社(Agence France Presse),白圣职衣,CYP1A2,和CYP3A4).表达水平标准化为磷酸甘油醛脱氢酶并与分化第0天hUC-MSCs的表达水平进行比较。采用双向方差分析,并且P-在分化第0、7、14和21天,将hLD-SCs的值与hUC-MSCs的值进行比较。P-值%3C 0.05被认为是显著的。n = 4。*,p% 3C 0.05;**,p% 3C 0.01;***,p%3C 0.001。
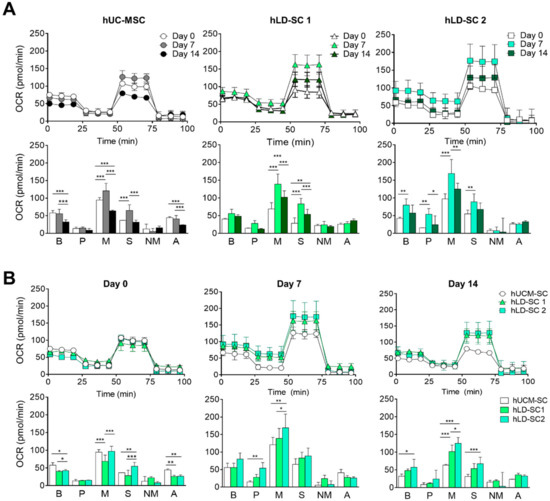
图4。肝分化过程中干细胞的线粒体耗氧率(OCRs)和生物遗传学特征。(A)海马分析期间的ocr和hUC-MSCs和两个hLD-SCs在向肝命运分化的第0、7和14天的线粒体生物基因图谱。(B)海马分析期间的ocr和第0、7和14天hUC-MSCs和两个hLD-SCs向肝命运分化的线粒体生物基因图谱。b、基础呼吸;p,质子泄露;m,最大呼吸;s,备用呼吸能力;NM,非线粒体耗氧量;一、ATP生产。P-值%3C 0.05被认为是显著的。n = 4。*,p% 3C 0.05;**,p% 3C 0.01;***,p%3C 0.001。
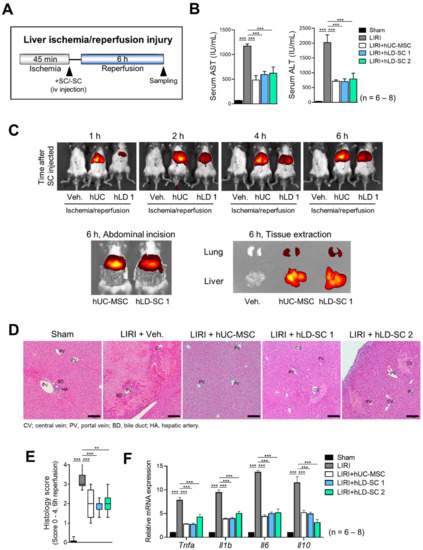
图5。肝缺血-再灌注损伤(LIRI)小鼠中hUC-MSCs和hLD-SCs的转运。(A)C57BL/6小鼠LIRI示意图。(B)血清天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平。P-值%3C 0.05被认为是显著的。n = 6表示假的;其他组n = 8。(C)hUC-MSCs和hLD-SCs用DiR荧光染料标记。给药后1、2、4和6小时测量荧光信号。在切开每只小鼠的腹部或提取相关组织后,测量荧光。(D)苏木精伊红(H&E)染色进行肝脏组织学。比例尺,200 μm(E)每只老鼠的铃木评分。(F)促炎细胞因子的基因表达水平(肿瘤坏死因子,Il1b,和Il6)和抗炎细胞因子,Il10。表达水平标准化为磷酸甘油醛脱氢酶并与假组的表达水平进行比较。P-值%3C 0.05被认为是显著的。n = 6表示假的;其他组n = 8。*,p% 3C 0.05;**,p% 3C 0.01;***,p%3C 0.001。
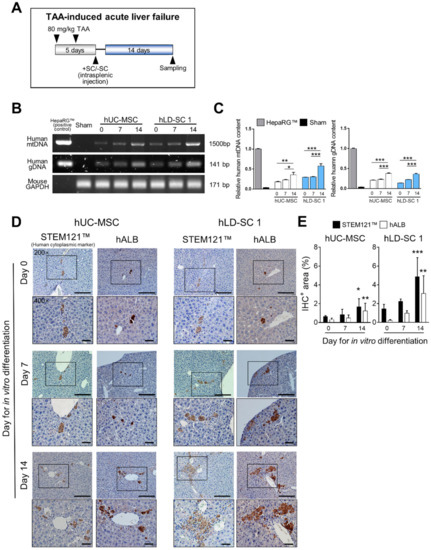
图6。硫代乙酰胺(TAA)诱导的急性肝衰竭小鼠自发肝细胞分化和成熟。(A)Rag 2 TAA致急性肝损伤示意图-/-Il2rg-/-(NRG)老鼠。在向肝命运分化的第0、7和14天,用脾内给药处理hUC-MSCs和hLD-SCs,小鼠恢复14天。(B)人类线粒体DNA的代表性聚合酶链反应(PCR)结果(人类mtDNA;扩增子大小,1500 bp),人特异性基因组DNA(人gDNA扩增子大小,141 bp)和小鼠基因组磷酸甘油醛脱氢酶(鼠标磷酸甘油醛脱氢酶;扩增子大小,171 bp)。从用于免疫组织化学的石蜡块中分离总DNA(IHC)。(C)相对人类mtDNA和gDNA含量的量化。将该含量与肝素的mtDNA和gDNA的量进行比较。总脱氧核糖核酸是从1 × 105HepaRG细胞。(D)干细胞移植后14天,小鼠体内人类干细胞121(人类细胞质标记物)和人类白蛋白IHC的代表性图像得以恢复。比例尺,100微米,放大200倍;比例尺,400倍放大50微米。(E)hUC-MSCs和hLD-SCs的STEM121和hALB阳性面积(%)表示为平均标准偏差,并将每个值与第0天进行比较。p-值%3C 0.05被认为是显著的。n = 3表示假的;其他组n = 4。*,p% 3C 0.05;**,p% 3C 0.01;***,p%3C 0.001。
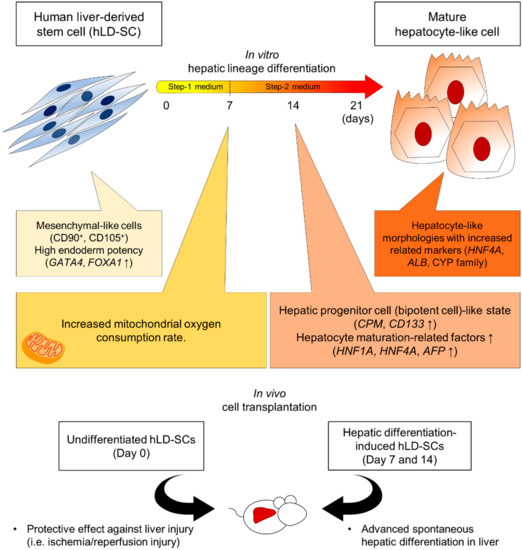
图7。化学性肝分化过程中体外特征的示意图。人肝源性干细胞(hLD-SCs)是多能性的、可扩展的,并显示出具有细长纺锤体形状和卵圆形细胞核的骨髓间充质干细胞样结构。hLD-SCs表达高水平的内胚层基因(GATA4和FOXA1).在两步化学肝分化的第7天,hLD-SCs具有较高的耗氧率(OCR),这与MSCs的分化潜能有关。在第14天,hLD-SCs表达高水平的肝祖细胞标记物,每千成本(cost per mille)和CD133随着肝细胞成熟相关基因表达的持续增加(HNF1A,HNF4A,和法新社(Agence France Presse)).在两步分化的第21天,hLD-SCs显示成熟肝细胞样细胞的标准特征,从扁平椭圆形转化为粗糙圆形。未分化hLD-SCs的体内细胞移植对肝损伤和肝分化诱导的hLD-SCs产生保护作用,这些HLd-ScS自发分化为成熟的肝细胞样细胞。
作者2020年。被许可方MDPI,巴塞尔,瑞士。本文是根据知识共享属性(CC BY)许可证的条款和条件分发的开放存取文章(http://creativecommons.org/licenses/by/4.0/).