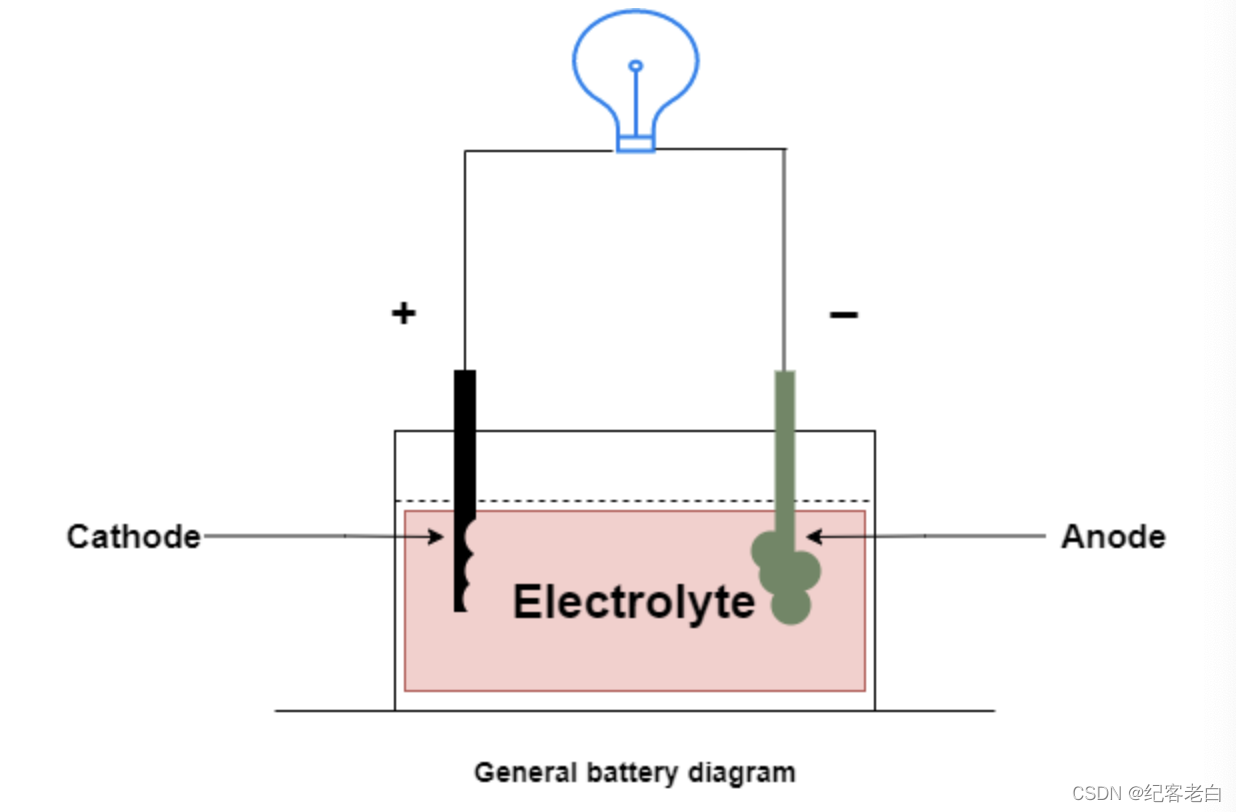
电池以化学能的形式储存电能,而化学能又能转化为电能。化学能转化为电能的过程称为放电。放电过程中的化学反应使电子流过连接在终端的外部负载,从而导致电子流向相反方向的电流。
有些电池可以通过施加反向电流将这些电子返回到同一个电子,这个过程称为充电。能够在同一电极上回收电子的电池称为可充电电池,如果它们不能这样做,则称为不可充电电池。
在电池中,发生还原的电极叫做阴极,发生氧化的电极叫做阳极。
市面上常用的充电池有三种。
- 铅酸蓄电池
- 镉镍电池
- 镍氢电池
- 锂离子电池
铅酸蓄电池
首先,铅酸蓄电池是在1859年由法国物理学家 Gaston Plante 发明的。这是一个负极(阳极)是由海绵或多孔铅。正极(阴极)由氧化铅组成。阳极和阴极电极都浸没在硫酸和水(稀硫酸)的电解液中。
铅酸蓄电池的放电
Pb + HSO4-ーーーー > PbSO4 + h + 2e- 在负电极上的反应
PbO2 + HSO4-+ 3H + + 2e-ーーーー > PbSO4 + 2H2O 正电极上的反应
总反应 Pb + PbO2 + 2h2so4ーーーー > 2PbSO4 + 2H2O
铅酸蓄电池的放电引起正极(阴极)和负极(阳极)上硫酸铅(PbSO4)晶体的形成,并由于铅的价电荷的变化而释放出电子。这种形成硫酸铅的方法是利用硫酸形成硫酸盐,硫酸是电池中的电解液。这使得硫酸在充分放电时浓度较低,两个电极都被硫酸铅和水覆盖,电极周围没有硫酸。在全放电时,电极被同一种材料完全覆盖,材料是硫酸铅,因此两个电极之间没有化学电位或电压。在实践中,早在这个点之前,就有一个截止电压来停止放电。
让我们来看看放电率,铅酸蓄电池通常指定在8,10,或20小时的比率是 c/8,c/10,c/20。如果你发现电池12v 200Ah/10h 或 c/10。
c/10 = 200 Ah/10 h = 20A
该 c/10米电压切断后的特定时间,这里10小时为 c/10。
铅酸蓄电池的充电
充电开始时,充电器是连接在正面和负面终端。铅酸蓄电池在负极将硫酸铅(PbSO4)转化为铅(Pb) ,在正极将硫酸铅(PbSO4)转化为氧化铅。化学反应在放电过程中发生逆转
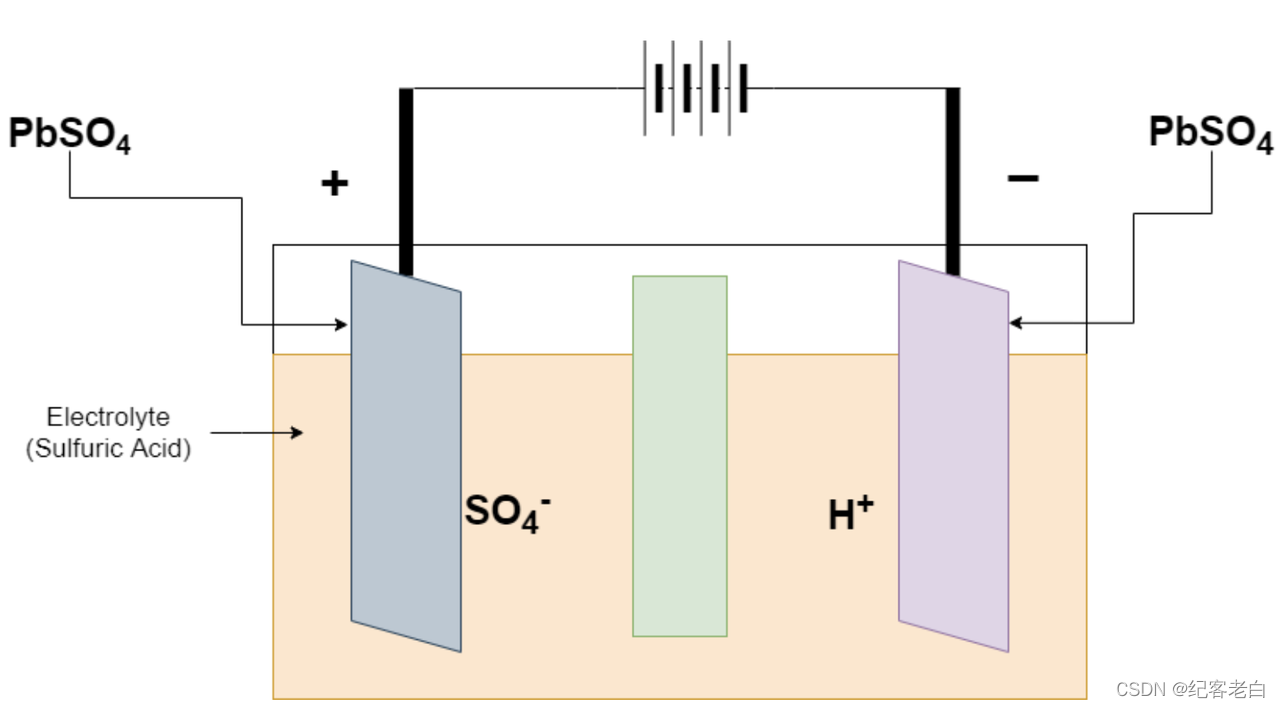
铅酸蓄电池的充电
PbSO4 + 2H2O 正电极上的反应ーーーーー > PbO2 + HSO4-+ 3H + + 2e-
PbSO4 + h + + 2e-ーーーーー > Pb + HSO4- 在负电极上的反应
全反应2pbso4 + 2H2O ーーーーー > Pb + PbO2 + 2H2SO4
充电电流从电解液中电解水,氢气和氧气都会产生这种过程,称为电池的“气体”。这种气体排放引起了电池的几个问题。由于产生的氢具有爆炸性质,这是不安全的。这也减少了电池中的水,可以手动更换,但它增加了一个维护因素。气体排放可能导致电解液中活性物质的遮蔽,从而永久性地降低电池容量,这就是为什么电池不应该定期充电超过导致气体排放的电压。放气电压可以随充电速率而改变
铅酸蓄电池的充电方法有多种。但是我们应该采用最好的方法来减少放气的机会,以获得最大的电池使用寿命和容量。下面给出的方法列表。
- 恒压:-作为一个名称,这种方法将提供恒定的电压,直到电池的电流为零。这需要很长时间
- 恒流:-作为一个名称,这种方法将提供恒定的电流,直到电压达到其规定的放气电压。这也需要很长的时间。
- 多级恒流充电电流:-在这种方法中,充电电流在电压达到放气电压时保持恒定,然后电流开始逐步降低,以保持电压低于放气电压。这个充电器制造起来很复杂。
- 改进的恒压恒流:-在这种方法电池充电三个阶段。第一阶段是恒流阶段,在这个电流施加到电池直到电压达到其规定的放气电压。在第二阶段,电压保持不变,直到电流减小到0.1 c20左右(也称为 C20/10)。电压是将降低到浮动电压(一般为2.25 v 到2.27 v) ,以保持电池充电。
充电电流和充气电压可以在电池的标签上找到,正如你可以在图中看到有两种模式可以选择充电电压和电流,这是待机使用和循环使用。循环使用是指需要快速充放电的电池的使用。待机使用是指电池已经充电并在需要时使用。0.1 c 意味着0.1乘以电池的总容量。如果你有一个40ah 电池,那么0.1 c 就是0.1 x 40 = 4 a。0.25 c = 0.25 x 40 = 10A.

铅酸蓄电池使用说明
铅酸蓄电池的寿命周期
铅酸蓄电池的寿命周期取决于多种因素。一般来说,浅循环电池的充放电周期约为200ー300次,但这个数字可以增加也可以减少。这种电池的寿命周期取决于三个因素: 放电深度、正确的充电周期和温度。深循环电池可以维持1000左右的生命周期,但什么是黄色循环和深循环?,你可以在下面找到它。
深度
放电深度(DOD)意味着电池的放电量。让我们假设你有一个100ah 电池,你已经放电20分钟,50A,所以放电深度给出如下
以小时计算的隐蔽时间 = 20/60
计算排放时间 = 50x20/60 = 16.7 a
排放深度 = (排放量/容量) x100 = (16.7/100) x100 = 16.7%
按照电池按按需要分为两类,即按需要具备50% 以上按需能力的电池, 深循环电池,
深循环电池即使放电深度超过50% 也能保持1000左右的寿命周期,而浅循环电池则可以很好地保持其寿命周期,如下图所示。
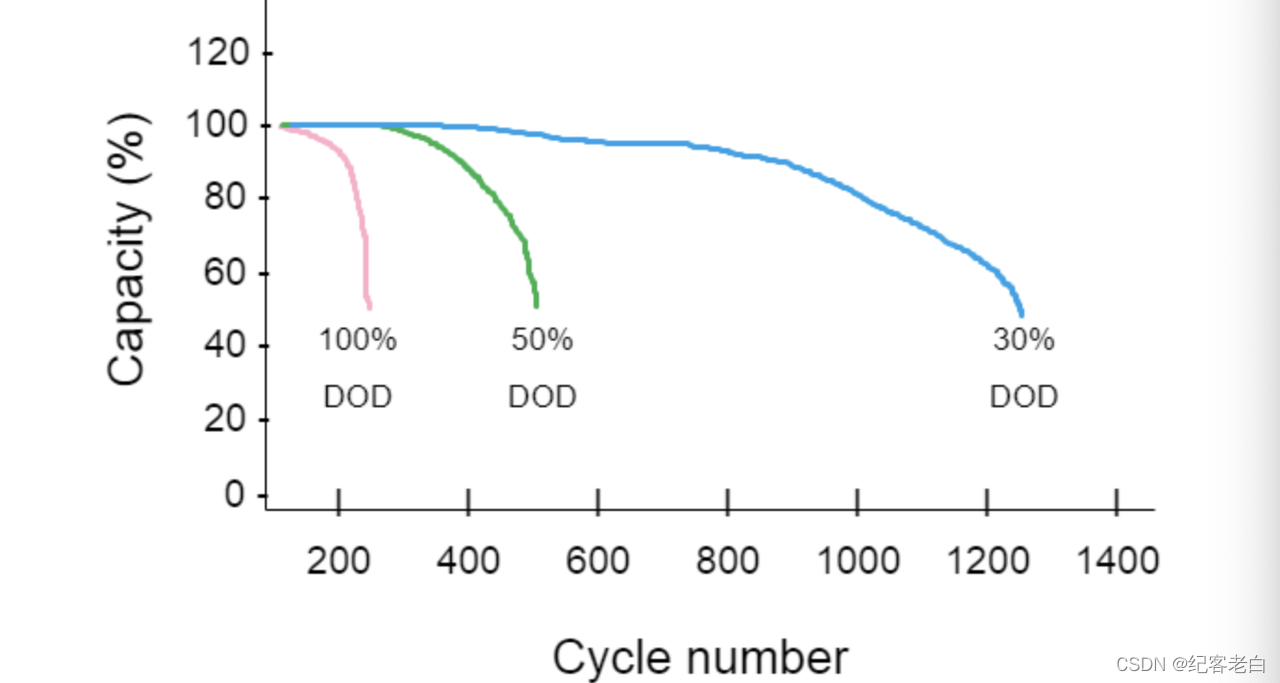
浅循环蓄电池容量、放电深度与循环寿命的关系
充电: 如果充电不正确,则会导致过充或充电不足,这也会降低电池的容量。
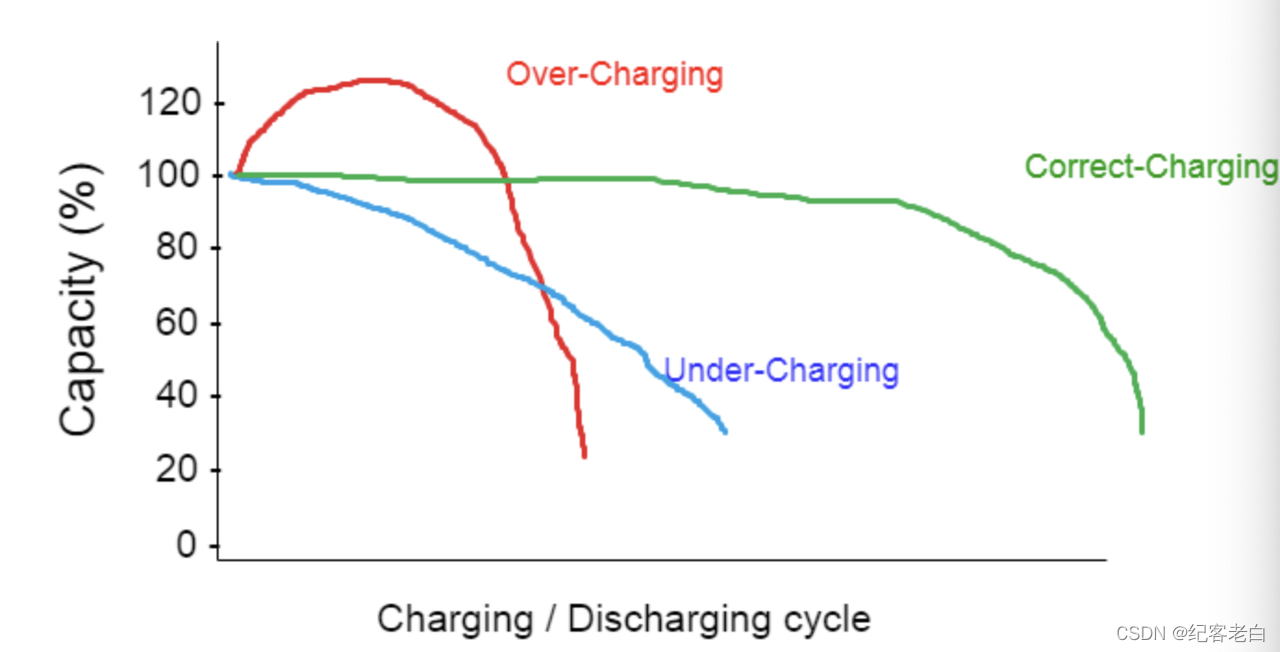
温度: 温度还影响电池的寿命周期,电池的容量在低温运行时降低,高温运行增加了电池的老化速度。
镉镍电池
首先,镉镍电池是在1899年由沃尔德玛 · 容格纳发明的。它的正极(阴极)由碱式氧化镍(NiO (OH))和负极(阳极)由金属镉(Cd)制成。所用的电解质是在蒸馏水中加入30% 的氢氧化钾。电解液的水平保持在电极上方。在充电和放电过程中,电解液没有明显的变化。
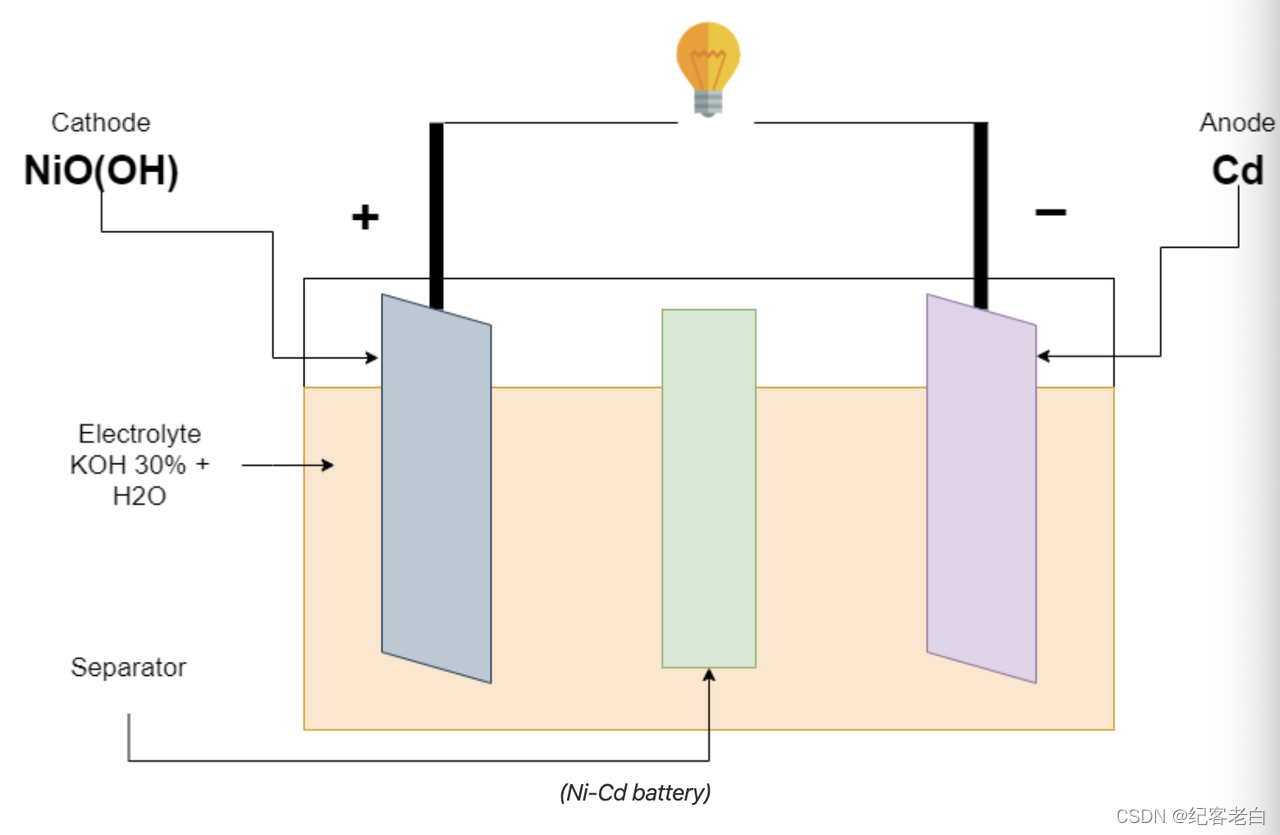
镉镍电池的放电
这种电池的放电/充电周期约为2000次。
其标称电压为1.2伏每个电池,其充电电压为1.55伏,当电压下降到1.1伏时完全放电,可通过串联电池增加电压。电池的容量由制造商决定,一般 AA 电池的容量接近1000mah。
镉镍电池的放电
当负载连接到终端时,电池开始放电。氢氧化钾(KOH)中的氢氧化钾分解成钾离子和羟基离子。羟基(OH -)离子走向负电极。负电极释放电子,正电极通过外部连接接收电子。这导致电流通过负载从正极流向负极。
Cd + 2OH ーーーー > Cd (OH)2 + 2e-在负电极上的反应
NiO (OH) + H2O + 2e-ーーーーー > Ni (OH)2 + OH-正电极上的反应
全反应 Cd + 2NiO (OH) + 2H2O ーーーー > 2Ni (OH)2 + Cd (OH)2
放电速率随电池的大小而变化,普通的 AA 电池可以提供大约1.8安培的电流,d 大小的电池可以提供大约3.5安培的电流。
镉镍电池的充电
在充电时,充电器在终端连接。反应由放电反向进行。正极将氢氧化镍转化为氢氧化镍并释放电子。负电子从外部连接处获得电子,并将 Cd (OH)2转化为 Cd。
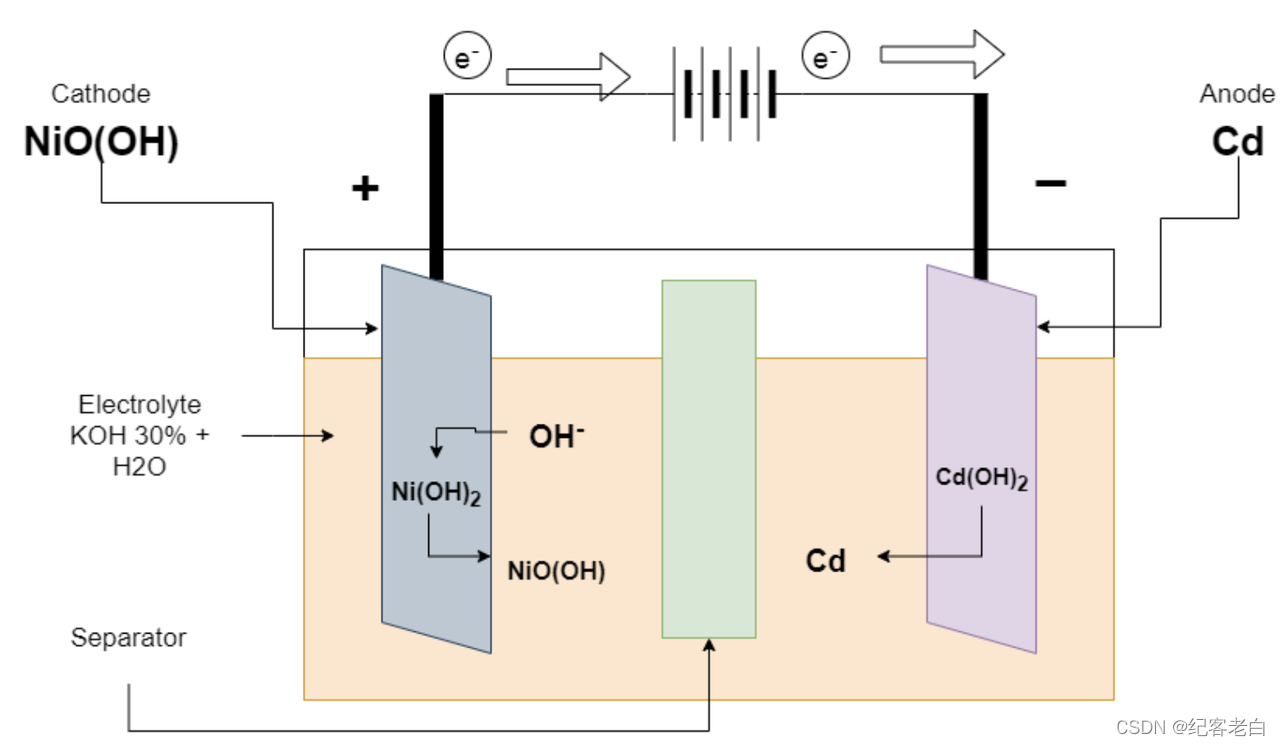
镉镍电池的充电
Ni (OH)2 + OH-ーーーーー > NiO (OH) + H2O + 2e-正电极上的反应
Cd (OH)2 + 2e-ーーーー > Cd + 2OH 负电极上的反应
总反应2ni (OH)2 + Cd (OH)2ーーー > Cd + 2NiO (OH) + 2H2O
在充电周期结束时,电池会放出气体,当电池充电过量时也会发生这种情况。从这种气体,水在电解质将分解成氢在负电极和氧在正电极。这种气体析出取决于电池充电所用的电压和温度。镉镍蓄电池要充满电,必须进行微量析气,从而利用电解液浓度中的一部分水。
镉镍电池有两种充电方式: 慢速充电和快速充电。
- 慢速充电:-慢速充电电流约为0.1 c,充满电后不会损坏电池。这种方法也用于克服镍镉电池的自放电现象。
- 快速充电:-在快速充电时,电池以约1摄氏度的恒定电流充电。是电池的容量,如果你用的是4ah 电池,那么1c 意味着1 x 4 = 4A。一旦它完全充电,可以通过下面给出的电荷检测算法检测到。电流将降低到0.1摄氏度,并采用滴流充电。滴流充电是指以与电池自放电相同的速率充电。这将保持电池在充满电状态。
全电荷检测算法可以使用两个因素负增量 v 或温度。
如果使用温度检测算法,那么快速充电时温度为45度,慢速充电时为50度。
在负增量 v 检测算法中,充满电后电压下降。这种液滴的检测可以用来检测全电荷状态。这种方法叫做负增量 v。这种方法提供了精确的全电荷检测。
镍氢电池
首先,1967年巴特尔-日内瓦研究中心发明了镍氢电池。2005年,三洋推出了 Eneloop 品牌。在这种电池中,正极(阴极)由碱式氧化镍和负极(金属氢化物)制成。所用的电解液是用蒸馏水浓缩的氢氧化钾。
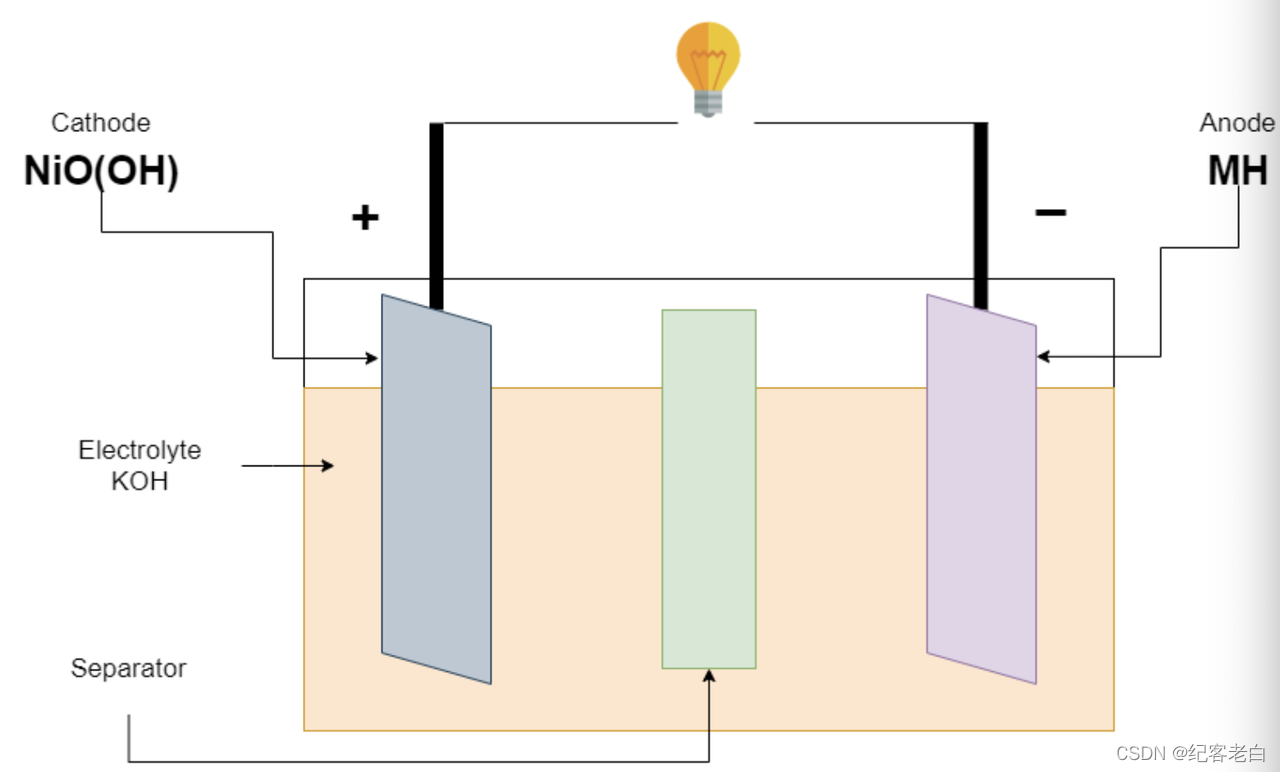
镍氢电池
这种电池的放电/充电周期约为180-2000次。这取决于各种因素,你如何充电或放电的电池。
这种电池几乎与镉镍电池相似。镍氢电池的标称电压为1.2 v,用于单个电池。但在充满电时,电压为1.5 v,充满放电电压为1.0 v。这种电池的电流容量随其大小而变化,一节 AA 电池的容量可以接近2000mah。
镍氢电池的放电
当负荷连接到终端时,开始发生放电反应。金属氢化物(MH)与 OH 离子反应生成 m 和水,也释放出一个电子。电子被 NiO (OH)通过外加载荷带走。这导致电流通过负载。
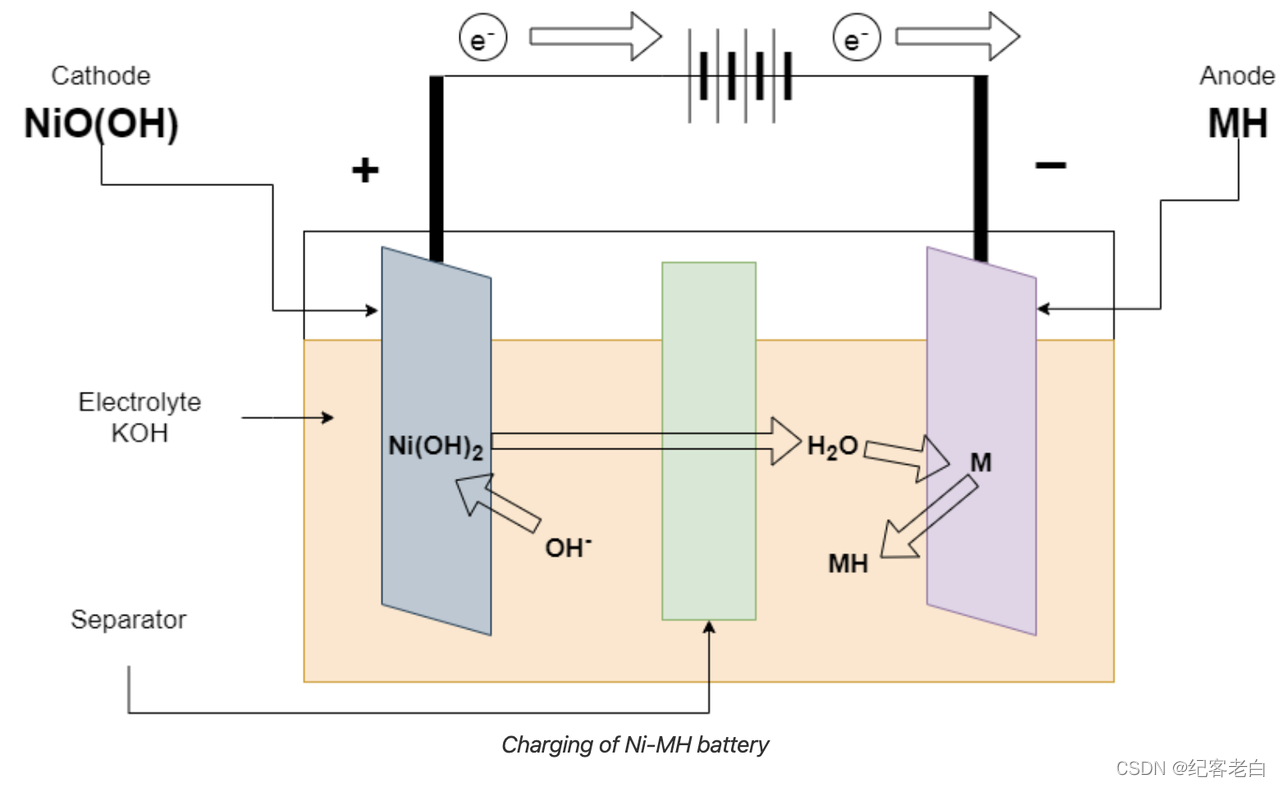
镍氢电池的充电
MH + OH-ーーーーーーー > m + H2O + e-中的反应
NiO (OH) + H2O + e-ーーーーー > Ni (OH)2 + OH-正电极上的反应
总反应 NiO (OH) + MH ーーー > Ni (OH)2 + m
正常情况下,镍氢电池的放电速率为3c (其中 c 是电池的容量,但高品质的电池可以放电高达15c 的速率。
镍氢电池的充电
在充电时,充电器连接在电池的末端,充电反应与放电反应相反。正极将氢氧化镍转化为水,并释放出一个电子。这个电子被负电极从外部导线和它从 MH 再次。
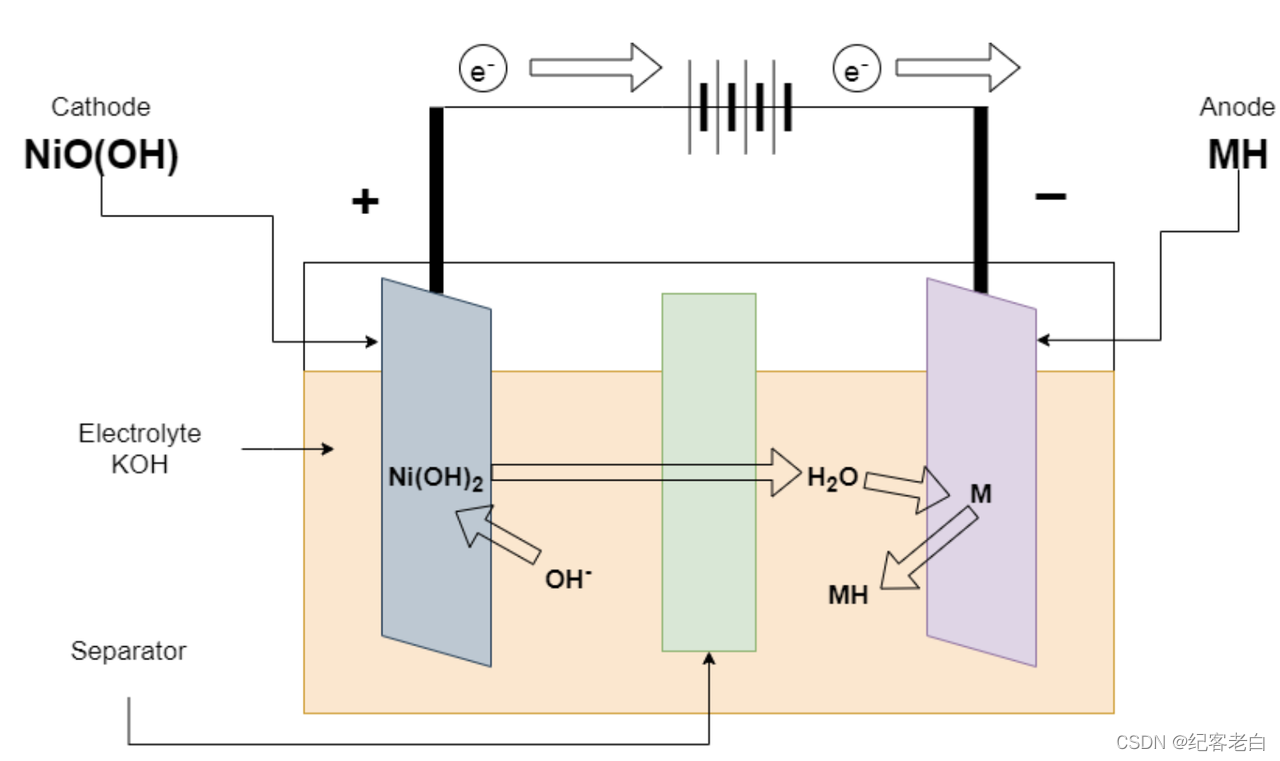
镍氢电池的充电
Ni (OH)2 + OH-ーーーー > NiO (OH) + H2O + e-正电极上的反应
负极 m + H2O + e-ーーーーー > MH + OH-的反应
总反应 Ni (OH)2 + m ーーーー > NiO (OH) + MH
镍氢电池充电化学利用恒流和恒压算法,可分为四个部分给出如下。
- 充电:-当电池深度放电时,每个电池的电压低于0.9 v。用来给电池充电的最大恒定电流为0.1摄氏度,这种电流称为滴流充电。
- 恒流:-当每个电池的电压高于0.9 v 时,在0.2 c 到1c 范围内施加恒流来进行恒流充电。
- 充电终端:-充满电的电池可以检测到一个完整的充电检测算法,这是解释如下。充满电后,涓流充电按照自放电的速度使用,以保持电池充满电。
全电荷检测算法可以使用两个因素负增量 v 或温度。
如果该算法利用温度来检测,那么温度将在45度到50度之间检测到充满电。
在负增量 v 检测算法中,充满电后电压下降。这种液滴的检测可以用来检测全电荷状态。这种方法称为负增量 v。这种方法提供了精确的全电荷检测。
锂离子电池
首先,吉野彰在1985年开发了一个锂离子电池。正极(阴极)由锂钴氧化物制成,负极(阳极)由石墨制成。锂盐作为一种有机溶剂被用作电解质。分离器用来分离电极
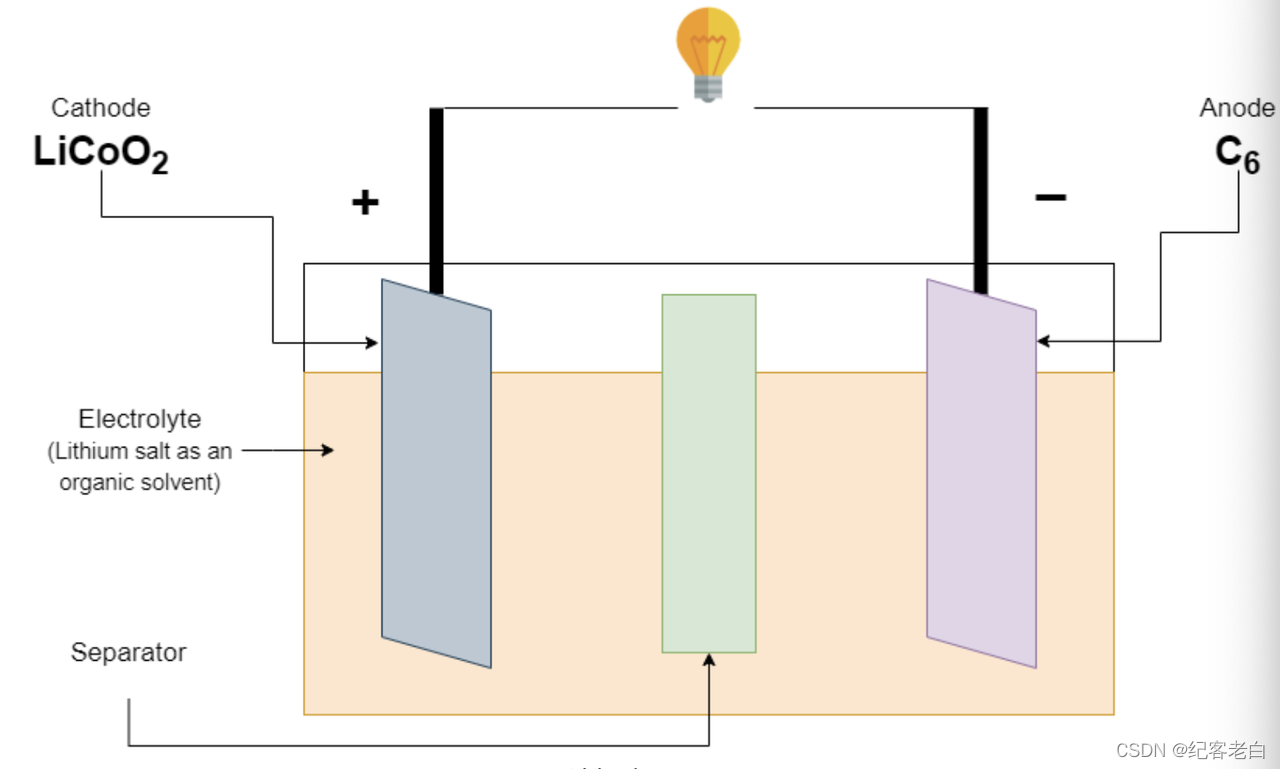
锂离子电池
这种电池的放电/充电周期约为400-1200次循环。这取决于各种因素,你如何充电或放电的电池。
锂离子电池的额定电压为3.60 v。当电池完全充电时,电压约为4.2 v,当电池完全放电时,电压约为3.0 v。锂离子电池有不同的尺寸和形状,其容量也可根据需要提供。
锂离子电池的放电
在电池放电时,负载连接到终端电池。锂离子从负电极中释放出来,进入电解液中。这种锂离子被正电极吸收。负电极也释放穿过外部导线到正电极的电子。这给我们的电路提供了电流。
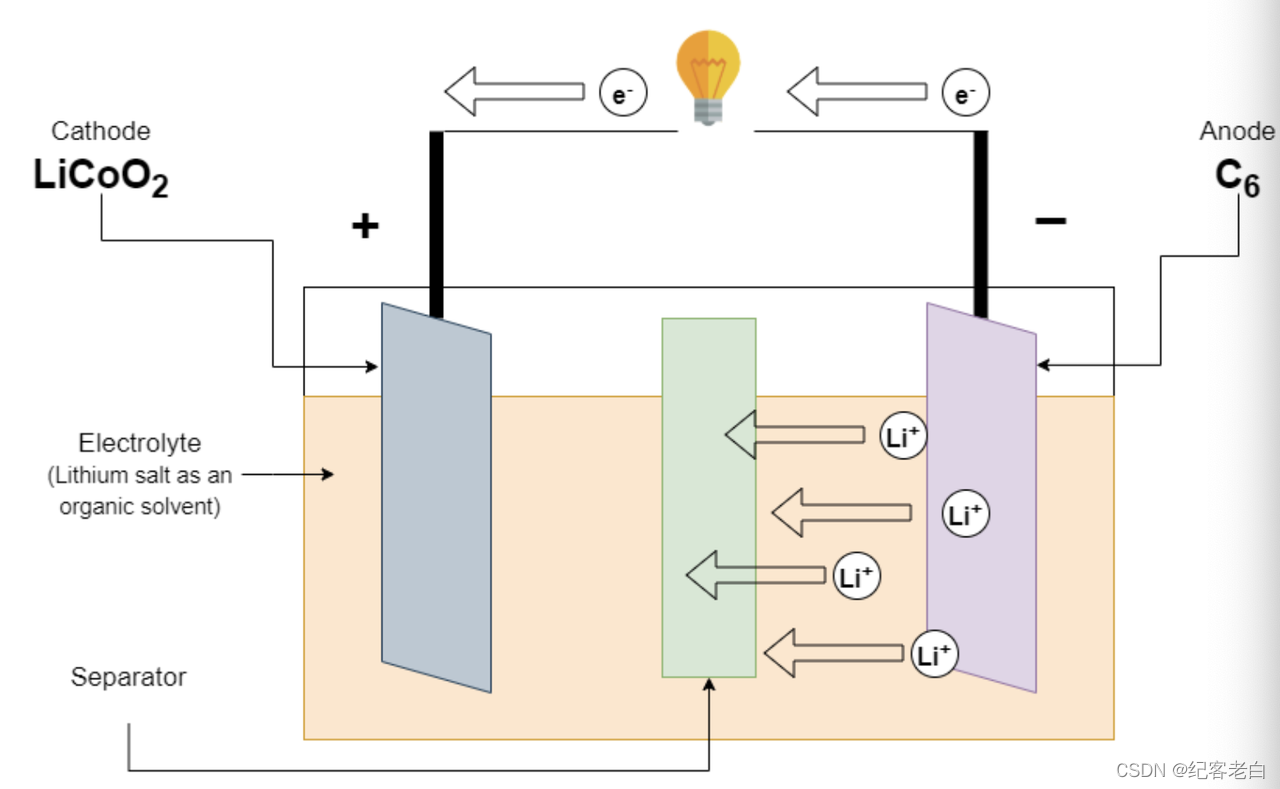
锂离子电池的放电
(锂离子电池放电)
Lic6ーーーーー > C6 + Li + e-在负极上的反应
Coo_2 + Li + e-ーーーー > licoo_2正电极上的反应
全反应 LiC6 + coo_2ーーーーー > C6 + LiCoO2
锂离子电池可以以10c 的速率放电(其中 c 是电池的容量)。如果你的电池可以提供1000mah,那么放电速率将是10x1000 = 10000mAh。
锂离子电池的充电
锂离子电池充电时,电池与充电器连接。正电极损失一个带负电荷的电子。为了维持负电极上的电荷平衡,等量的正电离子溶解到电解质溶液中。这些锂离子移动到正极,在那里它们被石墨吸收。这种吸收反应也将电子沉积到石墨阳极上,以“束缚”锂离子。
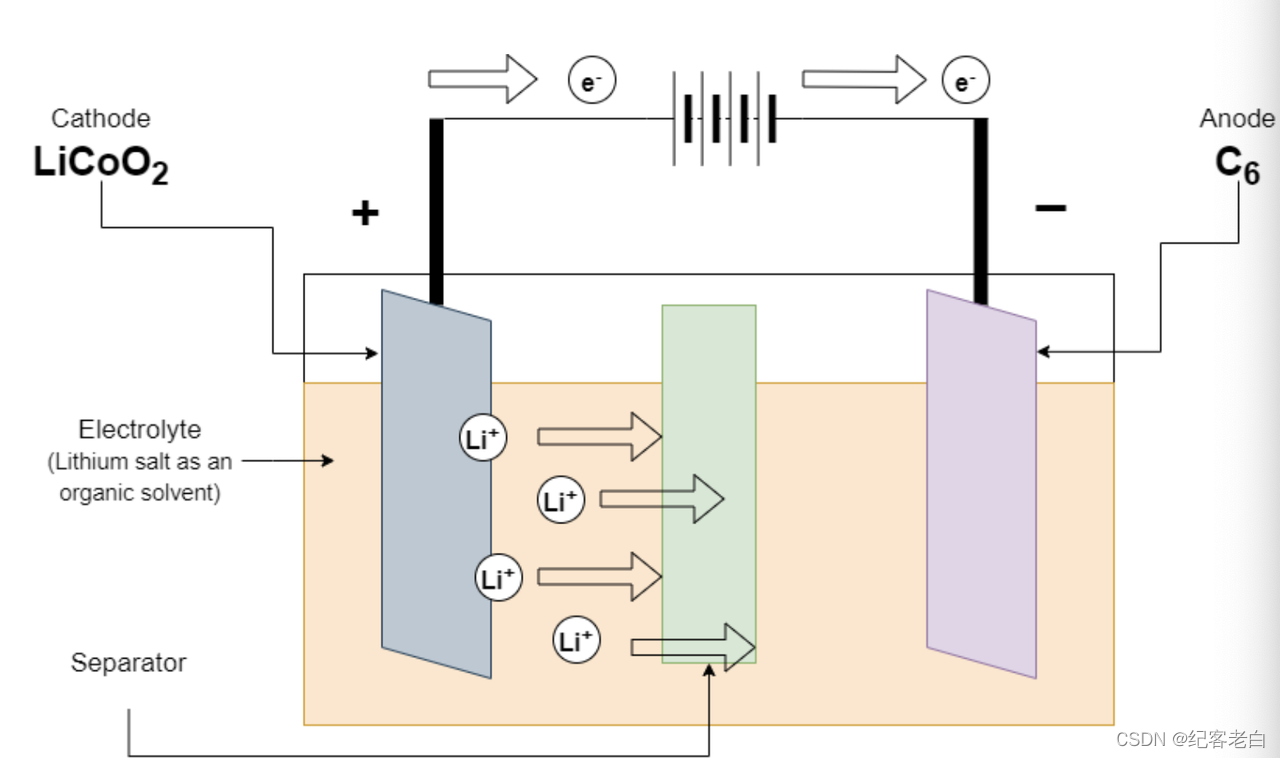
锂离子电池的充电
Licoo2ーーーーーー > coo_2 + Li + e-正电极上的反应
C6 + Li + + e-ーーーー > lic6负电极上的反应
全反应 C6 + licoo2ーーーー > LiC6 + CoO2
锂离子电池充电化学使用恒流和恒压算法,可分为四个部分。
充电:-当电池深度放电时,每个电池的电量低于3.0 v。用来给电池充电的最大恒定电流为0.1摄氏度,这种电流称为滴流充电。
恒流:-当电压高于每个电池3.0 v 时,在0.2 c 到1c 范围内施加恒流进行恒流充电。
恒压:-当电压达到每个电池4.2 v 的恒流充电。恒定的电压直到电池的电流降为零,这最大限度地提高了电池的性能。
充电终止:-充电结束检测算法,检测当前范围下降到0.02 c 到0.07 c 或使用计时器方法。它检测当一个恒定电压阶段启动它终止充电器后2小时的恒定电压阶段。
-
白纪龙老师从事电子行业已经有15个年头, 到目前为止已开发过的产品超上百款,目前大部分都已经量产上市,
-
从2018年开始花了5年的时间, 潜心录制了上千集的实战级电子工程师系列课程, 该课程从元器件到核心模块到完整产品
-
老白的初心是“愿天下工程师 不走弯路” 其中, 就有详细讲解MOS管和IGBT的课程!