磁共振扩散成像(diffusion magnetic resonance imaging, dMRI)是目前惟一一种能够无侵入性地检测白质微观组织结构完整性的技术。其中,基于高斯模型的扩散张量成像(diffusion tensor imaging, DTI)是最流行的dMRI技术,它已经被广泛应用到各种临床疾病的研究中[1-3]。然而,最近的研究发现大脑中很多组织的体素内存在多方向纤维束[4]。由于dMRI的空间分辨率一般是毫米级而水分子的扩散是微米(1毫米=1000微米)级的,单个体素内存在着成千上万种的扩散种类,水分子的平均扩散不一定符合高斯分布。因此,DTI受单高斯模型的限制无法揭示体素内多方向纤维束。扩散谱成像是一种不依赖于模型的多b值多方向的q空间成像[5],该方法利用概率密度函数描述扩散运动完整的空间分布,以优异的角分辨率精确辨别出局部复杂交错的纤维走行。随着扩散谱成像(diffusion spectrum imaging, DSI)的发展,大量的研究工作围绕着改善数据采集方式、减少扫描时间、提高角分辨率和普及临床应用等问题展开,使得这种方法成为扩散成像领域的一个研究热点。
1 扩散谱成像的基本原理
1.1 原理
在Stejskal-Tanner实验中,扩散信号随相位离散成e指数衰减:
![]() (1)
(1)
S0表示未加扩散梯度时的MRI信号,Φ表示扩散梯度引起的相位离散,SΔ表示施加扩散梯度后的MRI信号。假设两个扩散敏感梯度的间隔时间Δ远大于梯度持续时间δ,这时候水分子的离散相位:
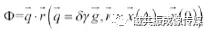 。公式中,
。公式中,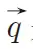 是回波矢量,γ是氢质子的磁旋比,
是回波矢量,γ是氢质子的磁旋比,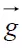 是扩散梯度。r是水分子在扩散时间Δ内的相对位移,
是扩散梯度。r是水分子在扩散时间Δ内的相对位移,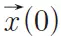 和
和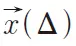 分别是水分子在第一个扩散梯度磁场和第二个扩散梯度磁场开始时的位置。如果把水分子的平均扩散看成是期望值,那么可以得到扩散信号和弥散概率密度函数如下关系:
分别是水分子在第一个扩散梯度磁场和第二个扩散梯度磁场开始时的位置。如果把水分子的平均扩散看成是期望值,那么可以得到扩散信号和弥散概率密度函数如下关系:
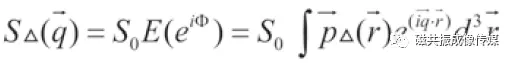 (2)
(2)
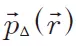 (probability densityfunction, PDF)表示一个体素内平均相对自旋位移的密度。
(probability densityfunction, PDF)表示一个体素内平均相对自旋位移的密度。
为了排除宏观运动(比如头动)的影响[6], DSI使用信号模进行傅里叶逆变换得到概率密度函数:
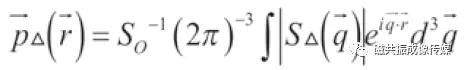 (3)
(3)
这里的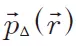 是通过傅里叶变换得来的,所以我们称它为扩散谱。
是通过傅里叶变换得来的,所以我们称它为扩散谱。
尽管DSI的理论要求扩散梯度磁场间隔时间远大于扩散梯度磁场持续时间,但在实际应用中受硬件条件的限制,这个假设一般不能满足。Wedeen等[6]进一步证实,即使扩散梯度磁场持续时间无法忽略,等式(3)依然成立。
1.2 数据采集和处理
DSI使用笛卡尔网格策略在一个球体内采集q空间的数据点。通常情况下扫描序列的梯度方向数至少需要200以上,最大b值要求8000 s/mm2以上,导致扫描时间长达数十分钟甚至1 h以上,这严重阻碍了其应用到临床上。DSI数据的常规处理步骤如下:(1)数据去噪(比如,加汉宁窗函数,卡阈值,小波去噪等);(2)对弥散信号的模进行3D反傅里叶变换得到PDF;(3)对PDF进行径向积分得到水分子扩散方向分布函数(orientation density function, ODF),使用ODF描绘纤维束的方向分布;(4)利用ODF计算一些定量指标(比如generalized fractional anisotropy, GFA);(5)使用基于ODF的流线型算法进行纤维束追踪[7]。
2 扩散谱成像的方法学研究
DSI最大的缺点就是数据采集时间过长,这导致患者可能无法忍受中途终止实验以及严重的头动问题。此外,优异的后处理方法能够提高ODF的角分辨率,从而揭示更可靠更复杂的微观组织结构。
2.1 数据采集效率的改进
由于q空间的扩散对比度是正的且球对称的,所以有研究提出使用半球壳采样DSI数据[8]。结果显示:相比于全球壳采样,半球壳采样不仅可以使扫描时间减半,同时保存了跟全球壳相当的角分辨率。Kuo等[9]通过优化DSI采集策略的最大b值和方向数发现,在保证较好的信噪比和角分辨率的情况下,DSI-515和DSI-203的最大b值分别对应6500和4000 s/mm2已经足够,减少的最大b值可以明显缩短扫描时间。Reese等[10]从序列角度出发,提出同步图像重聚平面回波序列,该序列通过改变射频脉冲可以一次激发两个层面,每个相位选择层面会被分别记录回波信号,在MRI信号重建时,数据被对分成2个阵列,经过傅里叶变换后,每个层面都各自产生1个影像,从而将扫描时间缩短了将近一半。Kuo等[11]提出一种新的非笛卡尔网格采集方式(body-centered-cubic, BCC),该方法采集每个晶胞的中心点而不是网格点,这种非矩形BCC策略的采样密度是网格采样的两倍。在相当的精度和准确度的情况下,BCC采样的最优b值和方向数都要比网格采样低,可以有效减少30%的扫描时间。Yeh等[12]提出结合双高斯模型的简化DSI编码(reduced-encoding DSI, RE-DSI)方法,假设生物组织的扩散信号遵循双高斯曲线分布,采集低q值的数据,然后利用双高斯模型拟合出高q值的数据。实验结果表明RE-DSI不但能够减少扫描时间同时保证相当高的纤维束定向精度和信噪比。最近Menzel等[13]尝试把压缩感知技术应用到DSI上发现了令人非常惊喜的结果。当加速因子R等于4时,水分子弥散的关键信息(比如ODF,扩散系数和峰度)都能够保存下来,同时DSI-128和DSI-515对应的欠采样使扫描时间可以分别减少到6 min和26 min左右,这已经基本达到临床要求,为推广DSI的临床应用提供了参考依据。
2.2 提高角分辨率
DSI假设水分子的扩散方向密度分布函数(diffusion orientation density function, dODF)的极大值方向就是纤维束的走向,但实际上它并不是真实的纤维束方向。为了改善对纤维束方向的估计,HARDI的研究已经利用反卷积的方法求得纤维束的方向密度函数(fiberorientation density function, fODF)[14]。数据验证显示fODF的角分辨率以及纤维束追踪的准确性都优于dODF,更适合描述纤维束的走向。Canales-Rodríguez等[15]认为DSI算法中的FT发生在全q空间,但实际进行3D FT的MR数据是有限的,所以常规的DSI处理得到的PDF并不是真实的,而是真实的PDF和一个点扩散函数的卷积。他们通过反卷积求得真实的PDF再对其进行径向积分求得ODF。结果显示,经过反卷积处理后的ODF在揭示交叉纤维束的精度,准确度以及稳定性上都更加令人满意。为了对不同采集策略的数据进行相同的反卷积处理,Yeh等[16]建立一个新的混合弥散模型,使用自旋密度函数(类似于ODF)来描述水分子的扩散行为,每个体素的平均扩散是由不同的扩散成分加权组成。研究人员采集了QBI(q-ball imaging),DSI和GQI(generalized-sampling imaging)人脑数据,并对这三种数据进行相应的处理得到dODF,然后反卷积dODF和一个特征函数得到fODF。数据结果表明,相比于dODF,fODF对于小角度(45°和60°)交叉纤维束的检查上和一些微小纤维束的评估上更加准确可靠。为了进一步提高fODF的精度,Yeh等[17]最近提出一种扩散分解的方法。该方法把fODF看成是一个回归方程的解,利用LASSO(least absoluteshrinkage and selection operator)算法评估fODF,该算法利用L1正则化促进回归方程解的稀疏性。模拟数据结果显示,相比于受限制的反卷积方法和棒球模型,扩散分解得到的fODF揭示交叉纤维束的能力更强,即使在信噪比较低的情况下。这个研究最突出的发现:由于扩散分解后的fODF具有非常高的角分辨率,30-QBI和40-DSI数据经扩散分解得到的fODF分别和252-QBI和202-DSI数据的特征相当,如此方向数的减少可以大幅度缩短扫描时间。
3 弥散频谱成像的应用研究
DSI最初的应用研究旨在揭示更加真实的微观组织结构。近年来,随着MR硬件的发展、扫描时间以及角分辨率的改善,DSI已经逐渐应用到临床疾病研究中,并且取得了突破性的进展。
3.1 微观组织结构的揭示
由于对多方向纤维束的检测失败,像舌头、肌肉、食道等组织内部包含大量有序排列的复杂的肌纤维,DTI无法揭示其完整的组织结构形态。Gilbert等[18-19]将DSI技术运用到牛舌头和食道的结构检查中,发现这些组织中存在大量的多方向纤维束,并且使用基于DSI-ODF的流线型追踪算法成功揭示了牛舌头和食道完整的纤维束结构,同时解析了这种复杂的纤维排列组成和生理功能潜在的动力学特征。Takahashi等[20]利用DTI和DSI两种技术探究了猫的大脑纤维束结构随年龄的变化。DSI结果表明:丘脑到皮层的神经纤维束起初比较平滑而且分支很少,随着年龄的增长,纤维束的形态逐渐弯曲而且分支越来越多。然而DTI对多方向纤维束的不敏感导致它无法揭示纤维束结构的这种变化。Schmahmann等[21]运用DSI技术在猴子大脑上识别出了10个长的联络纤维束。在一些有明显交叉纤维束的脑区,比如视交叉神经,半卵圆中心等,DTI追踪技术无法识别出而DSI成功地可视化这些纤维束的交叉走向。更重要的是,DSI揭示的所有纤维束的结构与自动放射线组织学追踪的结果高度吻合。Hagmann等[22]使用DSI和静息态fMRI对五名被试的脑结构和功能进行了研究,发现白质纤维束追踪识别的人类大脑的很多hubs(比如后内侧皮层,内侧额叶,颞上皮层等)正好对应的是默认网络的核心脑区,并且大脑的结构连接和功能连接间存在稳健的相关性。同时还发现了与功能网络类似的模块化特点,为进一步研究大脑的结构连接和功能连接的相互关系提供了重要证据。Granziera等[23]扫描了4名健康女性被试,运用DSI追踪技术展示了小脑皮层、深部和脑干的核团、丘脑间的神经环路模式,这也是研究人员首次揭示小脑复杂的网络连接,结果和之前在动物模型上的组织学研究相一致。最近Wedeen等[24]使用DSI技术追踪大脑的主要纤维束结构,通过分析比较每个纤维束与其邻近平行和垂直交叉的纤维束空间位置关系,突破性的发现人类和四种猴子大脑中的纤维束走向符合简单的几何分布,这个研究结果与我们“观念”中所理解的复杂的大脑微观结构不太一致。依据这个发现,理论上我们可以完全使用一些简单的数学模型就可以绘制或者预测大脑内部任意微观组织的纤维束结构,这为神经连接组学的研究提供了一个新的视角。
3.2 临床疾病的应用
由于DSI在揭示微观组织结构上的准确性、纤维束追踪上的可靠性以及近年来数据采集方式的改进,它已经被逐渐应用到一些临床疾病研究中,包括ADHD,精神病,中风以及自闭症等。Tang等[25]使用DSI技术研究亚皮层中风患者下肢对应的皮质脊髓束的完整性,通过比较障碍的下肢和正常下肢的皮质脊髓束的GFA值,他们发现障碍下肢的GFA显著降低,并且GFA值与下肢的运动功能高度相关。Wu等[26]运用DSI追踪技术研究ADHD儿童的额叶-纹状体回路的完整性变化。结果发现ADHD儿童的额叶-纹状体回路的四条纤维束的完整性都被破坏,并且眶额回到尾状核的纤维束完整性与患者的注意力缺陷的临床症状显著相关,这些发现为额叶-纹状体回路缺陷是ADHD潜在的病理机制的假说提供了依据。Griffa等[27]利用DSI技术找到了一些导致精神分裂患者脑网络完整性丢失的核心脑区,例如眶额回,额中回,额下回和顶叶等。进一步的图论分析显示:相比于正常组,患者核心脑区的拓扑属性以及连接它们的纤维束结构都发生了改变,它们通过一种最短路径的重新布局形成一个更加分散的网络。这些发现揭示了精神分裂病患者脑连接障碍的重要病理机制。Wu等[28]使用DSI技术研究带有听觉言语幻觉的精神病患者的结构网络和功能网络的关系。结果发现:患者组双侧的腹侧纤维束和右侧的背侧纤维束的完整性以及背侧路径的功能偏侧性减小,并且右背侧路径的完整性和背侧路径的功能偏侧性具有显著的正相关而背侧路径的功能偏侧性和右背侧路径结构完整性和临床评分呈负相关。这些发现成功揭示了带有听觉语言幻听的精神分裂症潜在的结构变化和功能变化之间的关系,促进了对该疾病病理机制的理解。
4 目前仍然存在的问题
DSI的方法学研究已经优化了它的扫描效率以及后处理方法,临床研究也日益增多,但是我们仍然面临着一些挑战。现有的DSI临床研究大都主要使用102个方向以及优化的最大b值4000 s/mm2的半球壳采样数据,然而扫描时间仍长达16 min左右(3T-MR),对于患者来说还是难以忍受,所以这些研究一般涉及到的被试数量相对较少,这也许使得最后的统计结果不是那么可靠。尽管我们之前提到的同步图像重聚平面回波序列采集,BCC采样,压缩感知等技术能够减少扫描时间,但是这些方法实现起来比较困难不易推广,如何找到一种扫描时间短并且简单可行的数据采集方式是未来我们研究的重点;目前DSI的方法学和应用部分的研究大都基于PDF的方向部分ODF,并没有关注它的径向信息。之前的研究已经表明,PDF的径向信息和轴突结构以及微观组织的破坏是有关系的,最近,基于多球壳采样方式,研究者们提出一些新的模型[29]直接研究PDF以及相关的定量指标的性质。结果显示,PDF相比于ODF更加稳定受噪音影响较小,纤维束追踪也更加准确。但是这些模型对q空间信号都有各自的解释,模型也是各有优缺点。这就需要我们进一步探索寻找一种不依赖模型的PDF研究方法;当前DSI的临床应用研究大都使用单一的定量指标GFA,这种单一的指标显然对于疾病的检测是不全面的。GFA和FA是高度相关的,它也会受到部分容积效应的影响。GFA的值对于不同的重建方法也许是没有可比性的,因为不同的重建方法得到的ODF的精度和角分辨是不一样的。另外,不同的采样方式和b值也会影响ODF的值。为了克服GFA这个问题,Yeh等[17]提出了一种新的指标quantitative anisotropy (QA),QA是对每个纤维束方向定义的,它通过ODF的峰值方向计算所得而FA和GFA都是针对每一个体素,这是它们最大的差异。在进行纤维束追踪时使用QA作为阈值可以减小部分容积效应同时过滤一些假的纤维束。在今后的研究中,我们需要结合其他的指标,比如基于PDF径向信息的P0或者MSD[30],对病理结构进行更加全面综合的检测,不同的指标也许对不同疾病的敏感性不一样,也许能够从不同的角度揭示病变信息。
5 总结
综上所述,尽管DSI在数据采集以及后处理的方法上面还存在一些的问题,但是由于其在揭示多方向纤维束上的优势,使得它检测到的纤维束结构更加真实可靠,这表明DSI在临床应用上潜在的巨大价值,一些初步的临床疾病的研究已经证明这一点。但是受软件和硬件的限制,DSI技术的临床推广还是非常缓慢。未来的研究任重而道远,值得欣喜的是,DSI使我们对人类大脑的了解又更进了一步,随着科技的发展,我们相信DSI技术在不久的将来势必取代DTI,成为磁共振扩散成像领域的新主流技术。
参考文献 [References]
[1]Shi F, Gao Y, Qiao PF, etal. Quantitative research of diffusion tensor imaging in cognitive impairmentsof Parkinson's disease. Chin J Magn Reson Imaging, 2015, 6(5): 326-332.
石峰, 高阳, 乔鹏飞, 等. 扩散张量成像在帕金森病认知障碍中的量化研究. 磁共振成像, 2015, 6(5): 326-332.
[2]Zhu HL, Ding JP, Wang FY,et al. A study diffusion tensor imaging of mild traumatic brain injury. Chin JMagn Reson Imaging, 2014, 5(6): 451-454.
朱慧玲, 丁建平, 王付言, 等. 轻度创伤性脑损伤的扩散张量成像研究. 磁共振成像, 2014, 5(6): 451-454.
[3]Nie TM, Jiang XY, Wang J.The value of diffusion MR imaging in differentiating atypical meningioma fromglioma. Chin J Magn Reson Imaging, 2013, 4(5): 325-329.
聂泰明, 姜兴岳, 王静. 扩散张量成像在不典型脑膜瘤与星形细胞肿瘤鉴别诊断中的价值. 磁共振成像, 2013, 4(5): 325-329.
[4]Behrens T, Berg HJ, JbabdiS, et al. Probabilistic diffusion tractography with multiple fibreorientations: what can we gain? NeuroImage, 2007, 34(1): 144-155.
[5]Wedeen V, Reese T, Tuch D,et al. Mapping fiber orientation spectra in cerebral white matter withFourier-transform diffusion MRI. Denver: Proceedings of the 8th annual meetingof ISMRM, 2000: 82.
[6]Wedeen VJ, Hagmann P,Tseng WY, et al. Mapping complex tissue architecture with diffusion spectrummagnetic resonance imaging. Magn Reson Med, 2005, 54(6): 1377-1386.
[7]Wedeen VJ, Wang R,Schmahmann JD, et al. Diffusion spectrum magnetic resonance imaging (DSI)tractography of crossing fibers. NeuroImage, 2008, 41(4): 1267-1277.
[8]Tefera GB, Zhou Y, JunejaV, et al. Evaluation of fiber tracking from subsampled q-space data indiffusion spectrum imaging. J Magn Reson Imaging, 2013, 31(6): 820-826.
[9]Kuo LW, Chen JH, WedeenVJ, et al. Optimization of diffusion spectrum imaging and q-ball imaging onclinical MRI system. NeuroImage, 2008, 41(1): 7-18.
[10]Reese TG, Benner T, WangR, et al. Halving imaging time of whole brain diffusion spectrum imaging anddiffusion tractography using simultaneous image refocusing in EPI. J Magn ResonImaging, 2009, 29(3): 517-522.
[11]Kuo LW, Chiang WY, YehFC, et al. Diffusion spectrum MRI using body-centered-cubic and half-spheresampling schemes. J Neurosci Methods, 2013, 212(1): 143-155.
[12]Yeh CH, Cho KH, Lin HC,et al. Reduced encoding diffusion spectrum imaging implemented with abi-Gaussian model. IEEE Trans Med Imaging,, 2008, 27(10): 1415-1424.
[13]Menzel MI, Tan ET, KhareK, et al. Accelerated diffusion spectrum imaging in the human brain usingcompressed sensing. Magn Reson Med, 2011, 66(5): 1226-1233.
[14]Tournier JD, Yeh CH,Calamante F, et al. Resolving crossing fibres using constrained sphericaldeconvolution: validation using diffusion-weighted imaging phantom data.NeuroImage, 2008, 42(2): 617-625.
[15]Canales-Rodríguez EJ,Iturria-Medina Y, Alemán-Gómez Y, et al. Deconvolution in diffusion spectrumimaging. NeuroImage, 2010, 50(1): 136-149.
[16]Yeh FC, Wedeen VJ, TsengWY. Estimation of fiber orientation and spin density distribution by diffusiondeconvolution. NeuroImage, 2011, 55(3): 1054-1062.
[17]Yeh F, Tseng W,Valdes-Sosa PA. Sparse solution of fiber orientation distribution function bydiffusion decomposition. PloS One, 2013, 8(10): e75747.
[18]Gilbert RJ, Magnusson LH,Napadow VJ, et al. Mapping complex myoarchitecture in the bovine tongue withdiffusion-spectrum magnetic resonance imaging. Biophy J, 2006, 91(3):1014-1022.
[19]Gilbert RJ, Wedeen VJ,Magnusson LH, et al. Three-dimensional myoarchitecture of the bovine tonguedemonstrated by diffusion spectrum magnetic resonance imaging withtractography. Anat Rec A Discov Mol Cell Evol Biol, 2006, 288(11): 1173-1182.
[20]Takahashi E, Dai G, WangR, et al. Development of cerebral fiber pathways in cats revealed by diffusionspectrum imaging. NeuroImage, 2010, 49(2): 1231-1240.
[21]Schmahmann JD, Pandya DN,Wang R, et al. Association fibre pathways of the brain: parallel observationsfrom diffusion spectrum imaging and autoradiography. Brain, 2007, 130(3):630-653.
[22]Hagmann P, Cammoun L,Gigandet X, et al. Mapping the structural core of human cerebral cortex. PLoSBiol, 2008, 6(7): e159.
[23]Granziera C, SchmahmannJ, Hadjikhani N, et al. Diffusion Spectrum imaging shows the structural basisof functional cerebellar circuits in the human cerebellum. PloS One, 2009,4(4): e5101.
[24]Wedeen VJ, Rosene DL,Wang R, et al. The geometric structure of the brain fiber pathways. Science,2012, 335(6076): 1628-1634.
[25]Tang PF, Ko YH, Luo ZA,et al. Tract-specific and region of interest analysis of corticospinal tractintegrity in subcortical ischemic stroke: reliability and correlation withmotor function of affected lower extremity. AJNR Am J Neuroradiol, 2010, 31(6):1023-1030.
[26]Wu YH, Gau SSF, Lo YC, etal. White matter tract integrity of frontostriatal circuit in attention deficithyperactivity disorder: association with attention performance and symptoms.Hum brain mapp, 2014, 35(1): 199-212.
[27]Griffa A, Baumann PS,Ferrari C, et al. Characterizing the connectome in schizophrenia with diffusionspectrum imaging. Hum brain mapp, 2015, 36(1): 354-366.
[28]Wu CH, Hwang TJ, Chen PJ,et al. Reduced structural integrity and functional lateralization of the dorsallanguage pathway correlate with hallucinations in schizophrenia: a combineddiffusion spectrum imaging and functional magnetic resonance imaging study. PsychiatryRes, 2014, 224(3): 303-310.
[29]Hosseinbor AP, Chung MK,Wu YC, et al. Bessel fourier orientation reconstruction (bfor): an analyticaldiffusion propagator reconstruction for hybrid diffusion imaging andcomputation of q-space indices. NeuroImage, 2013, 64: 650-670.
[30]Wu YC, Alexander AL.Hybrid diffusion imaging. Neuroimage, 2007, 36(3): 617-629.