【利用深度学习评估预测肺癌复发风险:Lung Cancer Recurrence Risk Prediction through Integrated Deep Learning Evaluation】
Background(背景)
1). 目前尚存的问题
近期,在预测IA期非小细胞肺癌(NSCLCs,属于肺癌的一种)完全手术切除肿瘤后的癌症进展风险方面,几乎没有取得显著进展。尽管一些生物标志物已经显示出一些预测价值,但尚不清楚这些标志物是否为传统的TNM系统(该是预测癌症患者复发风险的最佳工具)分期增加了价值。最近,完全切除的IA期非小细胞肺癌(NSCLC)的预后风险因素进展甚微。尽管一些生物标记物已被发现与癌症复发相关,但它们对TNM分期和肿瘤分级的附加价值尚不清楚。
虽然单独使用新辅助或辅助靶向治疗或免疫疗法或与化疗联合使用,成功地改善了IB或更高阶段可切除NSCLC患者的预后,但是这导致人们对确定可能受益于这些治疗以进一步提高治愈率的IA期NSCLC患者亚群的兴趣增加。目前,还没有经过验证的预后标志物来指导切除IA期NSCLC患者的辅助治疗。
早期识别具有高进展风险的IA期非小细胞肺癌对于指导医生积极治疗可能受益于早期癌症治疗的患者以抵消转移性疾病的发展具有重要作用。虽然许多有希望的血液或放射生物标记物被发现与非小细胞肺癌的进展相关,但没有一个标记物比公认的TNM分期和肿瘤分级标准对肺癌复发和死亡风险分层有显著的附加价值,并且癌症进展是一个复杂的过程,涉及手术前后的很多因素。
针对于AI肺癌复发预测的技术层次,还存在以下四个问题:
1.数据收集和标注的问题:AI模型的预测性能和准确性受到数据的质量和数量的限制。目前的研究大多数依赖于小样本或单中心的数据集,这可能导致模型的泛化能力不足,难以适应不同地区和不同类型的患者。此外,对于复发情况的定义和标准也存在差异,标注数据的一致性和准确性也需要考虑。
2.特征选择和模型优化的问题:对于不同类型的肺癌患者,其复发风险的因素可能各不相同。如何选择最相关的特征以及如何设计和优化模型,以提高预测性能和稳定性,仍需要进一步的探索和研究。
3.实际应用的可行性和可靠性问题:在实际临床应用中,AI肺癌复发预测模型需要与医生的临床经验和知识相结合,才能提高诊疗效果。此外,如何保障数据隐私和安全,防止数据泄露和滥用,也是需要考虑的问题。
4.解释性和可解释性问题:AI模型的黑盒性可能会降低患者和医生对预测结果的信任和接受度。因此,如何提高AI模型的解释性和可解释性,使其预测结果更易于理解和接受,也是需要研究和改进的方向。
2). 针对存在的问题,深度学习方法主要研究什么
在本研究中,作者开发了一种综合深度学习评估(IDLE)评分,将患者术前肺部CT图像表现与术后病理评估相结合,发现该评分比TNM分期和肿瘤分级更能预测癌症进展风险。IDLE评分预测值的提高主要是由于在整个肺的CT图像以及显微镜组织特征中补充使用了肿瘤测量。作者的研究支持在癌症风险评估中使用不同的非重叠肿瘤指标。该研究不仅有可能帮助治疗肿瘤学家改善早期NSCLC的临床管理,而且有可能帮助研究人员更好地定义患者选择标准,并确定在未来的临床试验设计中收集哪些测量值。
3). 较于传统算法,优势是什么?
1.更高的准确性和预测性能:AI模型可以处理更大量和更复杂的医学数据,能够在不同的数据特征之间进行学习和分析,从而更准确地预测患者的肺癌复发风险。
2.更快的预测速度:AI模型可以自动地处理和分析大量的医学数据,从而可以在短时间内快速给出预测结果,帮助医生做出更及时的诊断和治疗决策。
3.更全面的风险评估:AI模型可以综合考虑多种因素,如年龄、性别、肿瘤类型、治疗方式等,从而对患者的肺癌复发风险进行更全面的评估,帮助医生更好地制定个性化的治疗方案。
4.更少的主观因素干扰:AI模型基于数据进行预测,减少了医生主观因素的干扰,从而可以提供更客观和可信的预测结果,帮助医生更好地了解患者的病情和预后。
AI肺癌复发预测技术在准确性、速度、全面性和客观性等方面都具有优势,有望成为肺癌治疗和预后评估中重要的工具和辅助手段。
4). 深度学习评估预测肺癌复发风险的应用场景有哪些?
1.临床决策支持:AI肺癌复发预测技术可以为医生提供准确的患者肺癌复发风险评估,帮助医生制定更加个性化的治疗方案和随访计划,从而提高患者的治疗效果和生存率。
2.临床研究和试验:AI肺癌复发预测技术可以帮助研究人员更好地了解肺癌复发的风险因素和机制,从而指导肺癌治疗和预后评估的研究和试验。
3.健康管理和预防:AI肺癌复发预测技术可以对高风险人群进行筛查和监测,及早发现肺癌复发的迹象,从而提高预防和治疗的效果,降低患者的痛苦和医疗费用。
4.医疗保险和风险评估:AI肺癌复发预测技术可以为医疗保险公司和健康管理机构提供风险评估和预测模型,帮助其更好地评估患者的风险和保险费用,提高保险精准度和效率。
5). 可行性分析
目前,AI技术已经在医学领域得到了广泛的应用,AI肺癌复发预测技术的算法和模型也已经得到了较为成熟的发展,因此从技术角度来说,AI肺癌复发预测项目是可行的。肺癌是全球范围内的一个重大健康问题,而肺癌复发风险的评估和预测一直是医疗工作者和患者所关注的热点问题。因此,AI肺癌复发预测技术的市场需求非常大,具有广阔的应用前景和市场空间。AI肺癌复发预测技术的商业模式可以采取多种形式,如医院和诊所的直接销售、医疗保险公司和健康管理机构的定制化服务、研究机构和制药公司的科研合作等。因此,从商业模式的角度来看,AI肺癌复发预测项目也具有可行性。
数据集
- Lung Cancer Data Set
| 数据类型 | 图像(多特征)和压缩文件 |
|---|---|
| 大小 | 约1100个文件夹(每个文件夹有不同的图片和数据集压缩文件) |
| 实例数 | 32 |
| 属性数量 | 56 |
| 属性 | 所有预测属性都是标称的,取0-3的整数值 |
| 标签 | 属性1是类标签 |
| 摘要 | Hong和Young使用此数据来说明最佳判别平面的能力,即使在不适定的设置中也是如此。在生成的平面中应用KNN方法给出了77%的准确度。然而,这些结果有很大的偏差(参见上面Aeberhard的第二个参考文献,或发送电子邮件至stefan’@'coral.cs.jcu.edu.au)。Aeberhard等人获得的结果是:RDA:62.5%,KNN 53.1%,Opt. Disc. Plane: 59.4%;数据描述了3种病理性肺癌。作者没有给出关于单个变量的信息,也没有给出数据最初使用的地方。 |
| 数据源 | https://archive.ics.uci.edu/ml/datasets/lung+cancer;https://archive.ics.uci.edu/ml/machine-learning-databases/lung-cancer/ |
| 数据引用信息 | Hong, Z.Q. and Yang, J.Y. “Optimal Discriminant Plane for a Small Number of Samples and Design Method of Classifier on the Plane”, Pattern Recognition, Vol. 24, No. 4, pp. 317-324, 1991. |
- National Lung Screening Trial (NLST) Data
| 数据类型 | CT或病理图像 |
|---|---|
| 大小 | 75000多个CT 筛查检查的图像,200000多张病理图像系列 |
| 训练集 | 约2100,每个肺癌一个记录 |
| 验证集 | 54000名参与者 |
| 测试集 | 约 500 名的1200 多张病理图像 |
| 标签 | 48个 |
| 摘要 | 数据集很全面;它们包括有关参与者特征、筛查检查结果、诊断程序、肺癌和死亡率的数据。提供来自 75,000 多个 CT 筛查检查的图像。来自 NLST 肺癌患者子集的 1,200 多张病理图像(超过 2,000 名患者中的约 500 名)可以提供。 |
| 数据源 | https://cdas.cancer.gov/nlst/ |
| 数据引用信息 | Pan Z, Zhang R, Shen S, et al. OWL: An optimized and independently validated machine learning prediction model for lung cancer screening based on the UK Biobank, PLCO, and NLST populations[J]. EBioMedicine, 2023, 88. |
- Lung Image Database Consortium (LIDC) Data
| 数据类型 | 图像集 |
|---|---|
| 大小 | 244527张图片(124GB) |
| 方式 | CT(计算机断层扫描) DX(数字放射成像) CR(计算机放射成像) |
| 参加人数 | 1010 |
| 研究数量 | 1308 |
| 系列数 | 1308 |
| 摘要 | 肺部图像数据库联盟图像集 (LIDC-IDRI) 包括诊断和肺癌筛查胸部计算机断层扫描 (CT) 扫描,带有标记的注释病变。它是一种可通过网络访问的国际资源,用于开发、培训和评估用于肺癌检测和诊断的计算机辅助诊断 (CAD) 方法。这种公私合作伙伴关系由美国国家癌症研究所 (NCI) 发起,由美国国立卫生研究院 (FNIH) 基金会进一步推动,并在美国食品和药物管理局 (FDA) 的积极参与下,证明了这一公私合作伙伴关系的成功联盟建立在基于共识的过程之上。七个学术中心和八个医学影像公司合作创建了这个包含 1018 个案例的数据集。每个受试者都包括来自临床胸部 CT 扫描的图像和一个关联的 XML 文件,该文件记录了由四位经验丰富的胸部放射科医生执行的两阶段图像注释过程的结果。 |
| 数据源 | https://wiki.cancerimagingarchive.net/pages/viewpage.action?pageId=1966254 |
| 数据引用信息 | Armato III S G, McLennan G, Bidaut L, et al. The lung image database consortium (LIDC) and image database resource initiative (IDRI): a completed reference database of lung nodules on CT scans[J]. Medical physics, 2011, 38(2): 915-931. |
- IQ-OTH/NCCD - Lung Cancer Dataset
| 数据类型 | 图像集 |
|---|---|
| 大小 | 1190张图像,代表110例病例的CT扫描切片 |
| 类别 | 分为三类:正常、良性和恶性 |
| 每类样本数 | 40例被诊断为恶性;诊断为良性的15例,分类为正常的55例 |
| 摘要 | 专科医院收集了为期三个月的伊拉克癌症教学医院/癌症国家中心(IQ-OTH/NCCD)癌症数据集。它包括不同阶段被诊断患有癌症的患者以及健康受试者的CT扫描。这两个中心的肿瘤学家和放射科医生对IQ-OTH/NCD玻片进行了标记。每次扫描包含多个切片。这些切片的数量从80到200个不等,每个切片代表不同侧面和角度的人体胸部图像。110例病例的性别、年龄、教育程度、居住地区和生活状况各不相同。 |
| 数据源 | https://data.mendeley.com/datasets/bhmdr45bh2/2 |
| 数据引用信息 | alyasriy, hamdalla; AL-Huseiny, Muayed (2021), “The IQ-OTHNCCD lung cancer dataset”, Mendeley Data, V2, doi: 10.17632/bhmdr45bh2.2 |
- Data from 4D Lung Imaging of NSCLC Patients (4D-Lung)
| 数据类型 | 图像集 |
|---|---|
| 大小 | 347330个图片,共183GB |
| 方式 | CT、RTSTRUCT |
| 属性 | 参加人数:20;研究数量:589;系列数:6690 |
| 摘要 | 该数据集包括 20 名局部晚期非小细胞肺癌患者在放化疗期间获取的图像。这些图像包括四维 (4D) 扇形束 (4D-FBCT) 和 4D 锥形束 CT (4D-CBCT)。所有患者均接受同步放化疗,总剂量为 64.8-70 Gy,每日 1.8 或 2 Gy。4D-FBCT 图像是在 16 层螺旋 CT 扫描仪(Brilliance Big Bore,Philips Medical Systems,Andover,MA)上采集的,作为呼吸相关 CT,具有 10 个呼吸阶段(0 到 90%,基于相位的合并)和 3 mm切片厚度。 |
| 数据源 | https://wiki.cancerimagingarchive.net/pages/viewpage.action?pageId=21267414 |
| 数据引用信息 | Hugo G D, Weiss E, Sleeman W C, et al. Data from 4D lung imaging of NSCLC patients[J]. The Cancer Imaging Archive, 2016, 10: K9. |
技术方案
官方代码
R语言 for Windows或R for Linux 或 R for macOS(官方源代码)
库和依赖:
• texture.roi<- read.csv(“CT+HE features.csv”)
• library(survivalROC)
• library(survival)
• library(pROC)
• library(Hmisc)
• library(timeROC)
• library(e1071)
• library(Matrix)
• library(gplots)
自适应卷积神经网络肺癌预测代码
Pythpn语言,依赖和相关库函数:
• GPU optimized AWS EC2 instance
• Matplotlib
• Numpy
• OpenCv
• Pandas
• Pickle
• PIL
• Pydicom
• Scikit-image
• Scikit-learn
• Tensorflow
IDLE: Integrated Deep Learning Engine
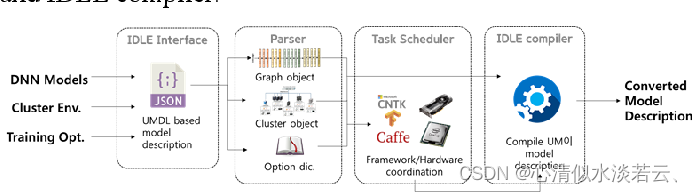
图1 IDLE中编译模型描述的总体过程
IDLE: https://ieeexplore.ieee.org/document/8650284

图2 在IDLE中算法编译的流程
IDLE建立在后端深度学习DL框架之上,是一种开发和维护DL应用程序的方便软件工具。为了提供方便、灵活的编程接口,借用一种JSON的统一模型描述语言(Unified Modeling Language, UMDL)来声明模型描述,并定义了一个层包装器,使最终用户能够从定义卷积、全连接和校正线性单元层的隐藏层级函数修改为矩阵乘法和累加等低级函数。一旦模型描述文件在UMDL中格式化,它就可以在计算节点中构建的任何后端框架上执行,而不考虑命令性或声明性接口。此外,它还使用任务调度方案协调后端框架和计算节点,同时考虑处理时间。在IDLE中编译模型描述的总体过程如上图所示。IDLE中有两个关键组件:任务调度程序和IDLE编译器。
(UMDL:https://en.wikipedia.org/wiki/Unified_Modeling_Language)
任务调度器旨在缓解异构GPU集群上执行大规模DL应用程序时的选择问题。它决定了参数服务器和工作程序,以及DL框架,以最大限度地减少总体处理时间。在调度器中,首先配置给定应用程序和GPU集群的信息,并使用启发式方法进行调度决策。它使最终用户能够有效地使用计算资源。IDLE编译器解析以UMDL格式格式化的模型描述,并将其转换为文件,以便在调度器确定的后端框架上执行。
将IDLE应用到肺癌复发中,即根据研究结合术前肺部 LDCT 图像纹理特征和切除肿瘤的组织学,使用集成深度学习评估 (IDLE) 预测肺癌进展风险的价值。其主要终点是无进展生存期,定义为从初始原发性肿瘤手术日期到肺癌复发、转移或肺癌相关死亡日期的时间,以先到者为准。死于肺癌以外的原因或存活但没有进展的患者在最后接触日期被删失。在模型中选择使用多层感知器MLP的理由是:(1)研究样本对于CNN算法开发来说不够大;(2)很难从自动创建的CNN图像特征中解码深度学习黑匣子来识别导致最终预测结果的驱动力分数。
整体架构
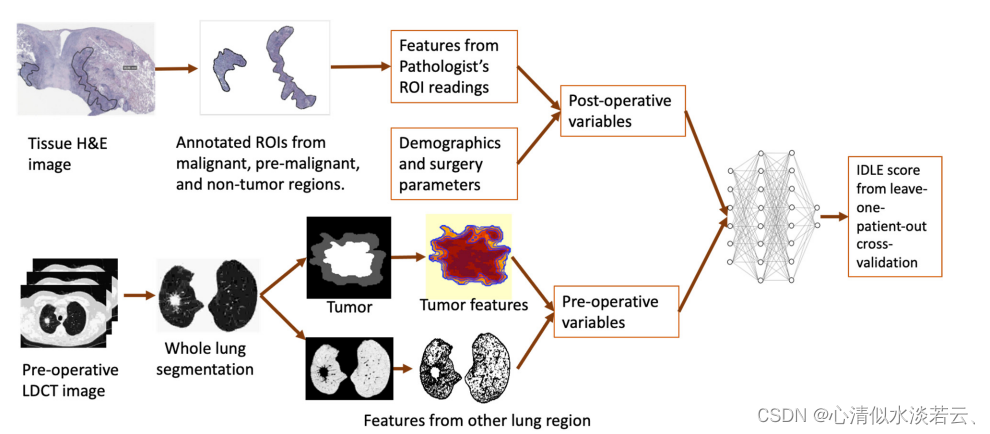 图3 学习程序
图3 学习程序
对于IDLE使用了以下输入变量,如图3所示。具体流程为:(1)手术时的患者人口统计数据,(2)手术类型(亚肺叶切除术或肺叶切除术),(3)手术后残留病灶(R0或R1),(4) 接受淋巴结切除术,(5) 手术组织相关特征(在补充表S1中列出),(6) 术前LDCT肺图像特征(在补充表 S2 中列出)在不同的肺解剖位置,以及(7) 间隔(在天)在术前 LDCT 肺筛查和手术之间。我们使用具有两个隐藏层和最后一层的 MLP,类似于我们之前的出版物 [25]。第一个隐藏层激活函数是从输入变量创建的,第二个隐藏层激活函数是从第一个隐藏层变量创建的,并具有适当的权重。带有L2惩罚参数的交叉熵损失函数用于两个隐藏层的特征选择和权重优化。最后一层使用随机生存林,输入变量和权重来自第二个隐藏层。网络的最终输出来自标准化为0和1之间的随机生存森林预测值。IDLE 分数通过留一患者交叉验证方法计算为预测风险分数。
(补充文件:https://www.mdpi.com/article/10.3390/cancers14174150/s1)
具体流程和方法
预处理:所有直径≥4mm的非钙化病变均纳入分析。手术切除的肿瘤与病理诊断有关,没有病理诊断的病变被视为不确定。为了分割肿瘤(或病变),我们首先使用3D立方体来定义其总体积,该立方体以至少1cm的边缘覆盖整个肿瘤。接下来,在应用形态学操作来定义肿瘤的表面体素之前,我们应用中值滤波器来去除图像噪声。从肿瘤和肿瘤周围体素值中减去来自相邻正常肺组织的体素强度中值,以归一化体素强度。然后,我们将300加到所有体素强度值上,使其为非负,从而使放射组学能量特征能够更有效地量化病变强度分布。
使用分割病变内的所有体素来定义其加权中心:
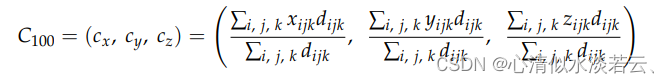
其中总和是在具有坐标 的所有肿瘤体素上,并且dijk是上公位置处的体素强度值。肿瘤体素空间分布的标准偏差通过以下公式计算:
的所有肿瘤体素上,并且dijk是上公位置处的体素强度值。肿瘤体素空间分布的标准偏差通过以下公式计算:

使用以下特征来比较分割病变(或肿瘤)内的体素与肿瘤周围区域的体素之间的强度分布:
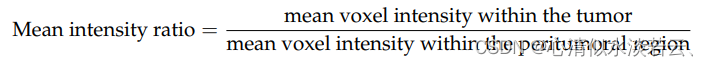
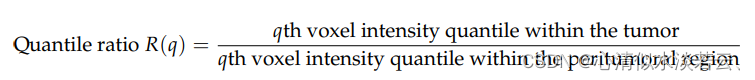
其中q分别为50和90。从每个LDCT图像中总共提取了173个特征。预测准确性评估标准包括5年和10年时间相关ROC曲线下面积(AUC)、时间相关阳性预测值(PPV)、时间相关性阴性预测值(NPV)以及高风险和低风险亚组之间无进展生存的风险比(HR)。选择最大化危险比的IDLE临界值来定义其高风险亚组。AUC的标准偏差是在500个bootstrap模拟中使用截尾加权估计量的逆概率计算的。使用贝叶斯规则计算与时间相关的PPV:

其中S(t)是t年无进展生存概率的Kaplan–Meier估计。与时间相关的净现值也进行了类似的计算。IDLE评分对TNM分期和肿瘤分级的附加值通过多变量Cox比例风险模型进行进一步评估,该模型根据手术、化疗和放疗时的年龄进行了调整。
我们采用了一种与IDLE使用的“不让一个患者参与”交叉验证方法略有不同的方法来了解深度学习黑匣子中的功能是如何使用。具体:使用相同的IDLE输入变量重新构建了IDLE网络,跟踪了输入变量在网络中的处理方式,根据在隐藏层中选择的次数对输入特征进行排名,最后使用在单变量logrank检验中最大化其风险比的阈值将这些变量分为两类,以癌症进展时间为终点。此外,重复了同样的分析,分别使用局部复发时间和远处转移时间作为终点。为了了解深度学习如何增强特征以及这些特征的集成方式,我们将输入变量与网络中的所有隐藏层特征相结合,并使用所有182名患者计算其值。使用t-检验(对于连续特征)和χ2检验(对于离散特征)来比较患有和不患有癌症进展的患者,进行单变量测试,以检查这些特征与癌症进展状态的相关性。从t检验或卡方检验中选择p值最小的前25个特征来构建热图,以可视化这些特征如何协同工作以提高预测精度。我们使用:

将这些z分数绘制在热图上。为了进一步评估术前LDCT图像特征和组织H&E图像特征之间的协同作用,我们使用完全相同的方法构建IDLE预测因子,以导出两个额外的深度学习预测因子:不使用H&E特征的LDCT特征衍生预测因子和不使用LDCT特征的H&E特征衍生预测函数。通过时间相关ROC分析将其预测精度与IDLE进行比较。
原型调制自适应卷积神经网络肺癌预测
整体流程
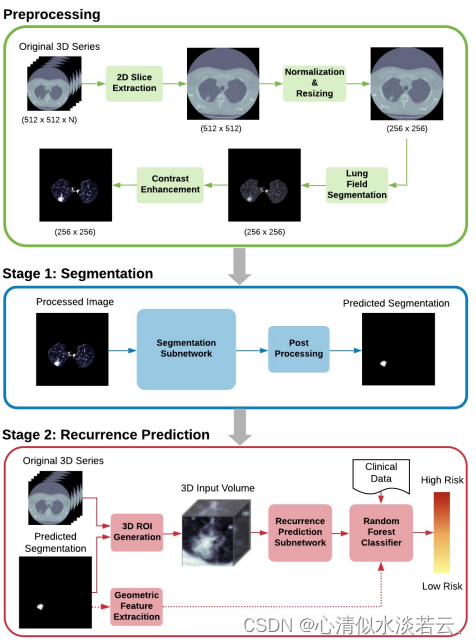
图4 提出方法的结节分割和复发预测框架
如图4整体流程。首先,对原始2D切片(包含最大肿瘤直径的切片)进行预处理,以调整图像大小并使其标准化,隔离肺野,并增加对比度。然后将其输入分割网络,在分割网络中预测肿瘤掩模并进行后处理。接下来,预测的掩模用于从原始CT序列中检索3D ROI,该3D ROI被馈送到3D CNN中用于复发预测。最后,将从预测分割中提取的CNN的输出、临床数据和肿瘤的几何特征用作随机森林分类器的特征。
分割结构
对于肺结节的分割模型,选择使用自适应U-Net。U-Net是CNN的一种变体,最近已成为许多分割任务的最新技术。改进:对原始架构进行了调整,以包含剩余连接。如图5所示。
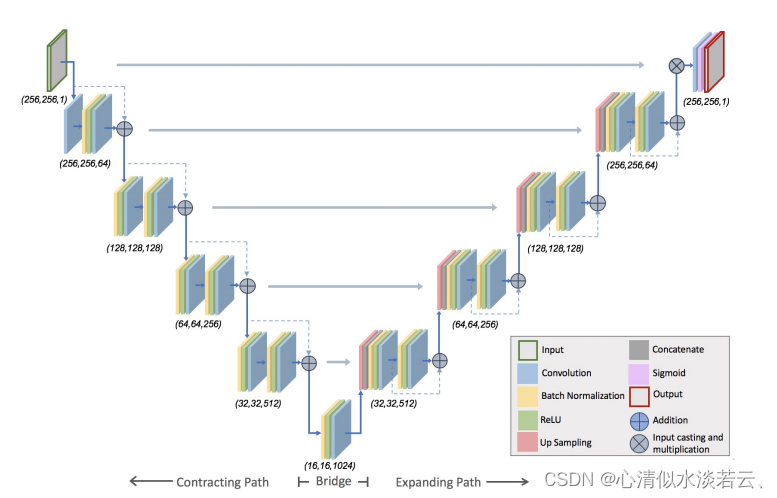
图5 用于分割的残差U-Net的体系结构
输出形状(图像x大小、图像y大小和通道数量)表示在每个单元下方。蓝色箭头表示网络的主路径,虚线箭头表示剩余连接,灰色箭头表示收缩和扩展路径的镜像单元之间的连接。图层的颜色表示不同的操作。沿着扩展路径,图像通过 (1×1) 卷积和 sigmoid激活。此激活之后是应用二元掩码以消除在肺部区域外检测到的任何误报。掩码是从网络的原始输入生成的。具体来说,由于我们的预处理程序会生成去除背景的归一化图像,因此对该图像应用天花板操作会创建肺野的二元掩膜。然后,将掩码应用于 sigmoid 的输出,从肺部区域外部移除任何错误激活的像素。
分割训练
预处理程序过后,将图像随机划分为基于患者ID的训练集、测试集和验证集。为了最大限度地增加用于训练的图像数量,所有包含结节组织的切片都包含在训练和验证集中。然而,对于测试集,仅考虑具有最大横截面肿瘤直径的图像。(在系统下一阶段的复发预测中,仅使用横截面肿瘤直径最大的切片来分割每个结节)
该模型是使用Keras 2.2.4实现的,使用tensorflow 1.14.0作为后端。由于非结节到结节像素的显著不平衡,使用加权二进制交叉熵作为损失函数:
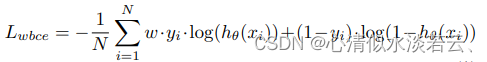
其中,N是样本数,w是给正类的权重,yi是第i个样本的真实标签,h(θ)是具有权重θ的网络,xi是第i个例的输入。我们对正类使用12.0的权重。对于我们的优化器,我们使用全局学习率为0.0001的Adam优化器
分割的后期处理。在网络的最终输出之后,进行少量的后处理。对于某些预测的分割,存在多个激活区域。这可能是由于同一图像中存在多个结节,或假阳性。为了简化向系统下一阶段的过渡(对单个结节进行复发分类)并消除潜在的假阳性,我们只选择其中一个区域在最终分割中保持激活状态。该区域将其选为激活最密集的区域。
公开项目源
项目代码开源,但是R语言编写,需要准备R语言编程环境:
项目开源地址:https://github.com/ph202203/stage-IA-NSCLC
论文链接:
Researchgate.net
MDPI
Ncbi.nlm.nih.gov
Automated Segmentation and Recurrence Risk Prediction of Surgically Resected Lung Tumors with Adaptive Convolutional Neural Networks
概述:
文章使用卷积神经网络 (CNN) 对术前计算机断层扫描 (CT) 图像中存在的肺部肿瘤进行分割和复发风险预测。首先,扩展医学图像分割的最新进展,使用残差 U-Net 来定位和表征每个结节。然后,将识别出的肿瘤传递给第二个 CNN 进行复发风险预测。该系统的最终结果由随机森林分类器生成,该分类器将第二个网络的预测与临床属性相结合。 分割阶段使用 LIDC-IDRI 数据集并获得 70.3% 的 dice 分数。 复发风险阶段使用美国国家癌症研究所的 NLST 数据集,AUC 达到 73.0%。提出的框架表明:首先,自动结节分割方法可以概括为广泛的多任务系统启用管道,其次,深度学习和图像处理有可能改进当前的预后工具。此外它还是第一个全自动分割和复发风险预测系统。
项目代码:https://github.com/maggiebasta/lung-cancer-thesis
论文pdf:https://arxiv.org/pdf/2209.08423v1.pdf
评价:此深度学习代码是第一个全自动分割和复发风险预测系统,给定肺部CT的2D轴向切片,可以返回图像中肺部区域的二进制掩码。
Multimodal fusion of imaging and genomics for lung cancer recurrence prediction
概述:
文中研究了多模态融合在这项任务中的潜力。通过结合计算机断层扫描 (CT) 图像和基因组学,展示了使用具有弹性网络正则化的线性Cox比例风险模型改进的复发预测。研究了最近包含 130 名患者的非小细胞肺癌 (NSCLC) 放射基因组学数据集,并观察到一致性指数值增加了高达 10%。 采用神经网络文献中的非线性方法,例如多层感知器和视觉问答融合模块,并没有持续提高性能。 这表明需要更好地适应这种生物环境的更大的多模式数据集和融合技术。
线性模型
-> 可以从 linear_cox.ipynb 运行
项目代码:https://github.com/svaishnavi411/multimodal-recurrence
数据集:https://wiki.cancerimagingarchive.net/display/Public/NSCLC+Radiogenomics
论文pdf:https://arxiv.org/pdf/2002.01982.pdf