文献名:Proteomic analysis reveals that Topoisomerase 2A is associated with defective sperm head morphology
作者:Jacob Netherton1, Rachel A. Ogle1, Louise Hetherington1, Ana Izabel Silva Balbin Villaverde2, Hubert Hondermarck3, Mark A. Baker
期刊名:Molecular & Cellular Proteomics
发表时间:2019 年 12月17日
单位:澳洲纽卡斯尔大学
样本:人类精子
技术:SWATH(Sequential Window Acquisition of all Theoretical Mass Spectra)
一、 概述
男性不孕症,或低生育能力,通常是通过观察精子的产生总量、细胞的活动力和整体形态来诊断的。由于精子形态评估具有较高的主观性,往往导致一些不必要的辅助受孕。因此本文通过基于LC-MS/MS的蛋白质组学分析,比较了高质量和低质量精子的核提取物。所得结果显示,特定蛋白质在低质量和高质量精子细胞中存在着显著差异。此外,本文还证明在精子头部存在的拓扑异构酶2A与不良的头部形态高度相关,发现拓扑异构酶2A可以用于在临床实践中确认男性不育的潜在新生物标记。
二、 研究背景

男性不育的主要问题之一是实际诊断。虽然对精子总数和精子活力的测量在世界范围内是一致的(现在通常用计算机测量),但是对精子形态的分析存在明显的问题。根据《世界卫生组织手册》(1992年),精子可能有多种形态异常,包括头部、尾部和/或中段的缺陷,或者细胞可能有多余的残留细胞质。尽管精子形态是由特定的标准来指导的,实验室内部和实验室之间的差异仍然普遍存在。有报告显示,差异超过12%。事实上,在1391对接受辅助受孕的夫妇中,包括男性和女性不孕不育的案例,45.6%最终是自然受孕的。这表明许多夫妇被误诊,因此迫切需要更好的生育预后指标,尤其是关于男性生育潜力的指标,以避免对患者进行过度治疗。
三、 实验设计

四、 研究成果
1、 精核的分离、纯度和生化特性
使用不连续的Percoll密度梯度(30%、60%、100%)处理精子样本,分离获得高质量和低质量精子。如图1A所示,与处于100/60%渗透界面处的精子相比,位于管底的精子具有更高的密度。大多数(>90%)的低密度细胞(低质量精子)具有明显差的形态和运动能力,包括非晶态头部(图1B上,黑色箭头);相反,高密度的细胞(高质量精子)富含形态正常、有活力和高繁殖力的精子(图1B下,白色箭头)。
如图1C,采用微分干涉(DIC)观察法对来自高质量或低质量精子的400多个细胞核进行计数,结果表明没有证据显示尾巴或中段断裂,并且在细胞核上没有明显的差异。此外,目前还没有圆形细胞污染,这表明细胞核是高纯度的。
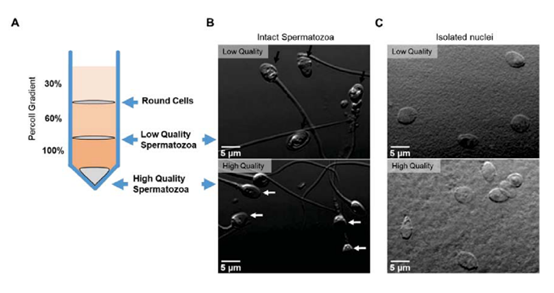
图1. 用Percoll密度梯度法分离高、低质量精子
2、 低质量馏分中染色质压实度的差异
高/低质量精子经Percoll分离后,用SNS/EDTA处理、DAPI染色,结果显示一些来自低质量精子的染色质快速解凝或增大(图2A,白色箭头)。为了量化这一点,使用图像J来测量处理后两个种群的细胞核面积。在每种情况下,低质量细胞的DAPI染色区域显著高于高质量细胞(图2B)。这些数据表明,尽管未观察到核形态的明显差异,但来自低质量精子的染色质比来自高质量细胞的染色质更容易受到SDS-EDTA的影响,因此来自低质量精子的染色质可能不那么紧密。
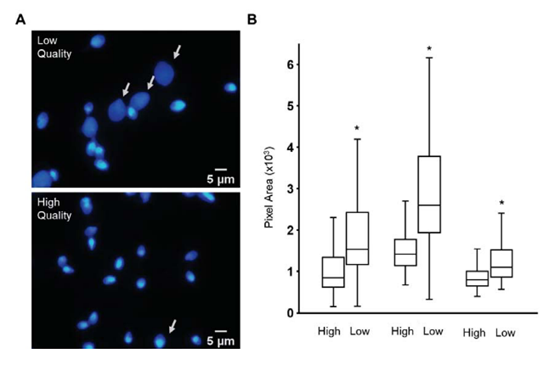
图2 低质量精子的细胞核经SDS/EDTA处理后更容易发生解凝
3、 生成SWATH 谱图库,SWATH定量分析
胰酶消化后,从6个供体中随机选择5个高、6个低质量精子的11个样品,在数据依赖模式下运行质谱仪,生成光谱文库。该文库由389个蛋白质组成,其中包括1331个多肽和8797个光谱,整体FDR为 1%。
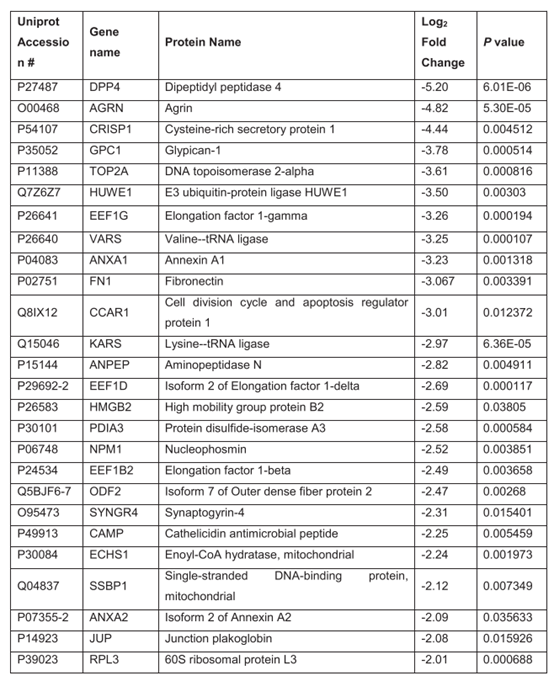
通过SWATH采集模式在Triple-ToF 6600上对8个捐赠者多的高/低质量精子样本进行检测,使用Perseus软件对SWATH数据进行相对定量。对数据进行log转换,通过配对的Welchs t检验,发现两组间共有26个蛋白存在显著性差异,占总蛋白的6.7%(389个中的26个),具有显著调控的蛋白见表1。
表1 在低质量精子中,Percoll密度梯度分离后的蛋白含量明显增加。
4、 在低质量的细胞中,鱼精蛋白2和组蛋白没有变化
SWATH数据显示无论是精蛋白2还是任何组蛋白都没有显著差异。为了证实这一点,本文使用抗组蛋白H3的抗体来比较高质量和低质量的精子,SDS免疫印迹检测结果显示H3和对照αTubulin没有变化(图3A),并且SWATH数据分析组蛋白H3的丰度在两组间无显著差异(图3B)。
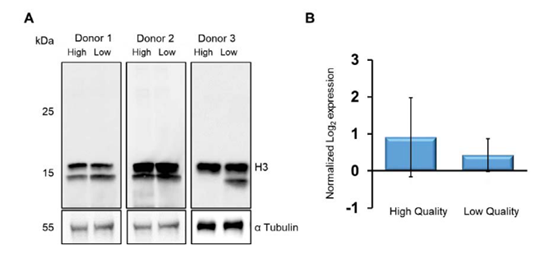
图3 组蛋白H3在高质量精子和低质量精子之间是一致的
5、 低质量精子中含有更丰富的蛋白质
观察表1可以发现,所有的蛋白在不同的组间存在显著差异,而在低质量精子中则更为丰富。为验证SWATH数据分析,本文从表一中选择倍数明显发生变化的拓扑异构酶 2A(TOP2A)和蛋白质二硫键异构酶A3 (PDIA3)进行免疫印迹。结果所示,PDIA3蛋白在低质量精子的细胞核内更为丰富(图4A);但供体间差异明显,1号供体的PDIA3含量似乎低于3号供体(图4B)。但是,在所有情况下,PDIA3在低质量精子的细胞核中始终较高,这符合作为标准化表达绘制的蛋白质组学数据(图4C))(注意,与高质量精子细胞相关的负值是由于对中位数的标准化)。
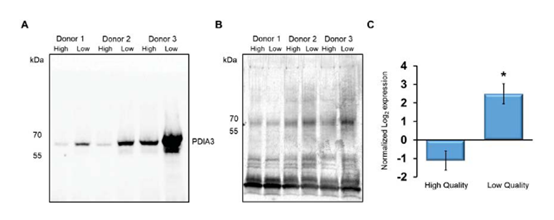
图4 PDIA3在低质量精子中含量较高
PDIA3免疫细胞化学分析显示完整精子的染色差异很大(图5A)。结果表明,该蛋白位于细胞的几个不同区域,包括多余的核膜(图5A、ii、a)、核周膜(图5A、ii、b)和残余的细胞质(图5A、ii、c)。
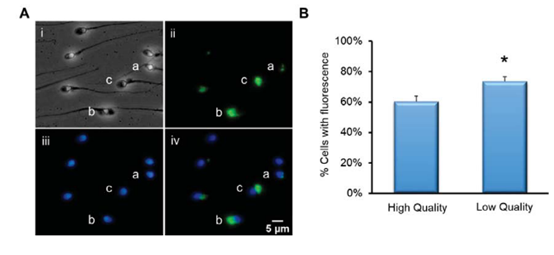
图5 PDIA3的免疫细胞化学分析
6、 Top 2A与低质量的精子头有关
免疫印迹分析显示,TOP2A(图6A)在低质量精子中更为丰富,这与SWATH定量数据一致(图6B)。免疫组化染色显示,TOP2A定位于残余的核膜(图7A)。多余的核膜由精子发育过程中细胞核压实后核膜的过度覆盖构成。图7A,iv显示了TOP2A与DAPI染色细胞核的接近度,表明TOP2A是精子细胞核腔室的一部分。在精子中使用抗TOP2A抗体荧光,计数统计发现在低质量精子中的TOP2A数量与在高质量精子中TOP2A数量存在显著差异(图7B)。最后本文确定不论精子来自Percoll密度梯度的哪个部分,绝大多数呈现TOP2A阳性的精子均表现出无定形的头部(图8)。
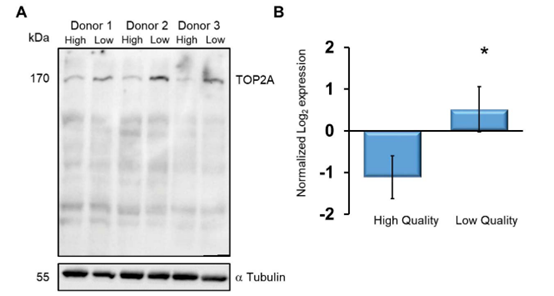
图6 来自低质量精子中TOP2A含量更高
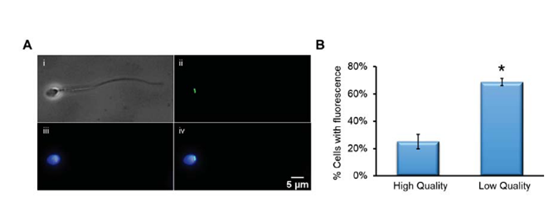
图7 免疫荧光检测精子中的TOP2A,证明该蛋白与无定形头部相关
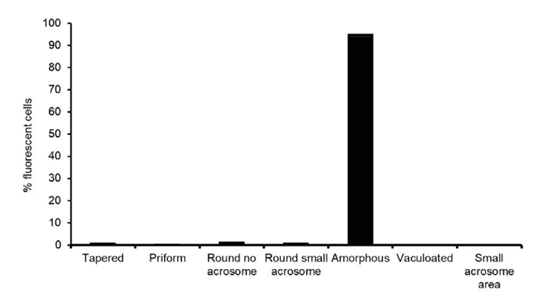
图8 TOP2A与无定形精子头相关
五、 文章亮点
在精子形成过程中,精子基因组被包装成接近晶体状态,核体积也减少至任何体细胞的1/7。本文通过密度梯度来分离低质量和高质量的精子,并从低/高质量精子分离细胞核进行SWATH定量分析,发现低质量精子细胞核中含有更丰富的蛋白质。经过免疫印迹和免疫细胞化学等实验验证,TOP2A与无定形的精子头高度相关,因此,在临床实践中,TOP2A可能成为男性不育的一个新的生物标志物。
解读人:卜繁宇
原文链接:https://www.mcponline.org/content/19/3/444