1. Modèle de Rutherford
En 1908, Rutherford a continué à bombarder la feuille d'or avec des particules α et a découvert qu'un très petit nombre de particules avait un très grand décalage. Ceci est contraire à l'analyse théorique dominante du modèle du pain aux raisins à cette époque.
Un atome peut être considéré comme composé d'un noyau chargé positivement et de quelques électrons se déplaçant autour du noyau. Le noyau au centre de l'atome est chargé positivement et concentre presque toute l'énergie de l'atome, et les électrons chargés négativement se déplacent autour du noyau. .

2. Quantification d'énergie, effet photoélectrique, spectre
2.1. La proposition de quantification d'énergie
(1) Rayonnement du corps noir
Qu'est-ce que le rayonnement thermique avant de comprendre le rayonnement du corps noir ? Tout d'abord, tout problème peut continuellement rayonner, absorber et émettre des ondes électromagnétiques. Les ondes électromagnétiques rayonnées sont différentes dans chaque bande, c'est-à-dire qu'il existe une certaine répartition spectrale. Cette distribution spectrale est liée aux caractéristiques de l'objet lui-même et à sa température, on l'appelle donc rayonnement thermique .
Bien sûr, après que l'objet a absorbé le rayonnement, le changement de température ne continuera pas à augmenter et la température de l'objet ne changera plus, c'est-à-dire que le rayonnement et l'absorption de l'objet atteignent un équilibre.À ce moment, le rayonnement thermique de l'objet est appelé rayonnement thermique d'équilibre, et le rayonnement thermique de l'objet à ce moment est appelé équilibre .
Connaissant la définition du rayonnement du corps noir, vous pouvez alors obtenir la définition du corps noir : un objet qui peut absorber complètement tout le rayonnement électromagnétique externe (
rayonnement de différentes longueurs d'onde) et ne réfléchit ni ne transmet. Par exemple, la suie (le taux d'absorption est d'environ 99 %) et les grottes avec de petits trous.
Quels sont donc les avantages d'étudier les corps noirs ? En 1859, Kirchhoff a prouvé que la forme et la position de la densité d'énergie de rayonnement du corps noir en fonction de la courbe de fréquence à l'état d'équilibre ne dépendent que de la température thermodynamique du corps noir et n'ont rien à voir avec le matériau et la forme du corps noir de la cavité. De cette manière, nous pouvons utiliser les propriétés spécifiques du corps noir pour ignorer le matériau pour étudier la loi du rayonnement thermique elle-même.
(2) Quantification des échanges d'énergie
Dans 2.1, la définition du rayonnement thermique est que l'onde électromagnétique émise par un objet après chauffage est liée à sa propre température caractéristique, et le rayonnement du corps noir n'a rien à voir avec le matériau et la forme.Le spectre de rayonnement d'un corps noir uniquement dépend de la température du corps noir . Différents physiciens ont analysé le rayonnement du corps noir et proposé le théorème de déplacement, la formule de Wien et la quantification de l'énergie de Planck.
En 1893, Wien a proposé la loi de déplacement, c'est-à-dire que la valeur de la longueur d'onde de l'onde de rayonnement la plus forte à différentes températures peut être déterminée grâce à cette formule, comme le montre la figure ci-dessous :
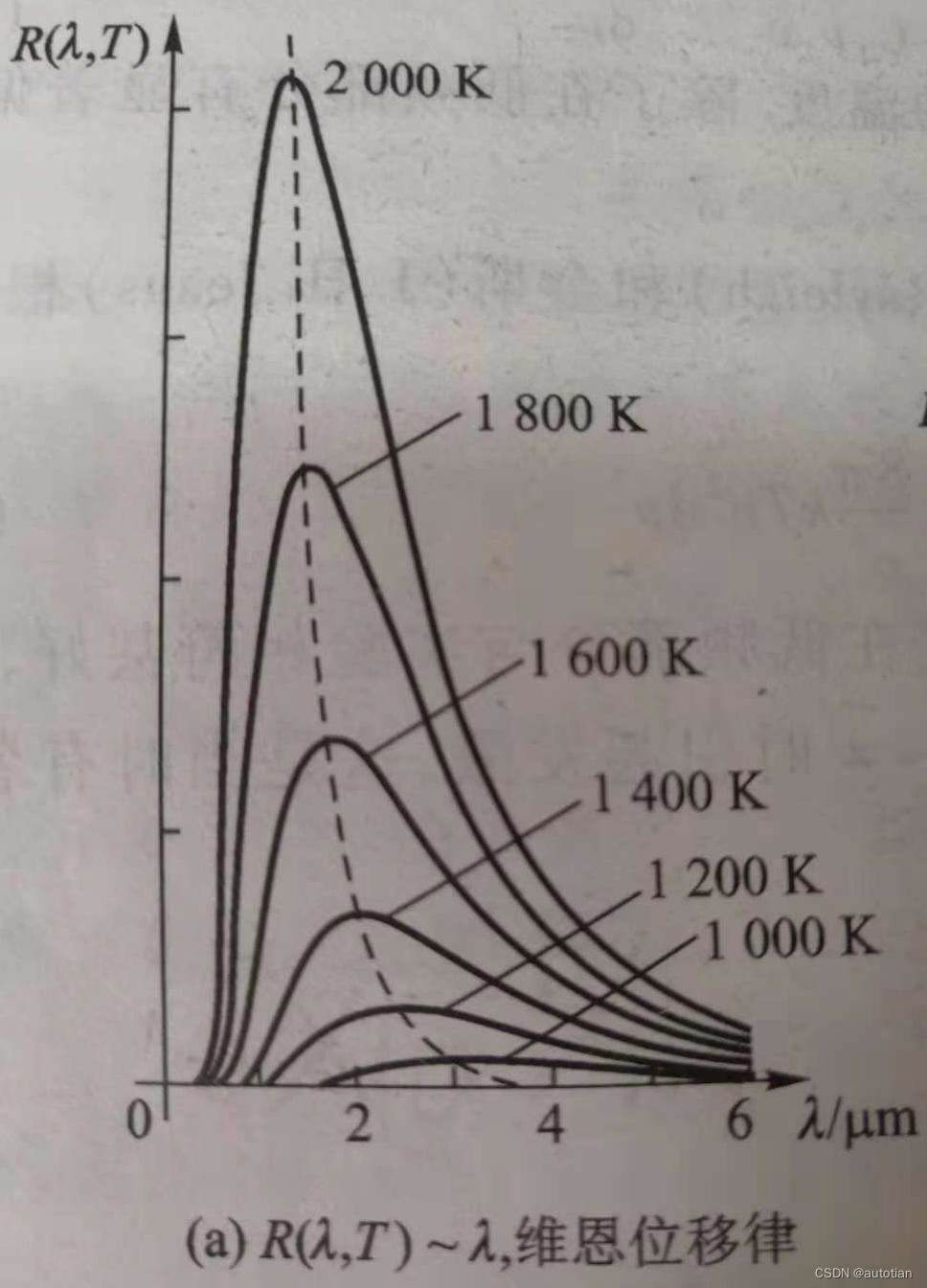
En 1896, sur la base de l'analyse des données expérimentales, Wien proposa la formule de Wien : , mais la partie haute fréquence ne correspond pas très bien aux résultats expérimentaux, comme le montre la figure :
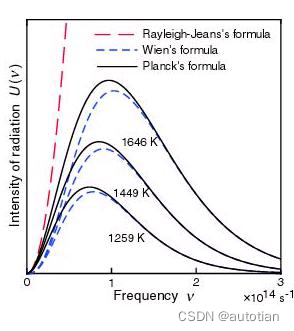
En 1900, le physicien allemand Max Planck a proposé lors d'une conférence de physique allemande que l'échange d'énergie du rayonnement électronique ne peut être quantifié , et la formule est exprimée comme suit : (où E est l'énergie de l'oscillateur harmonique chargé par l'onde électromagnétique rayonnée, v est le fréquence, h est la constante de Planck
)
Signification : briser la vision classique selon laquelle "toute l'énergie de processus naturel est continue", frapper à la porte de la mécanique quantique.
2.2 Effet photoélectrique
En 1887, le physicien allemand Hertz a découvert que la pointe du métal irradiée par la lumière violette est particulièrement sujette à la décharge de pointe ;
En 1897, Thomson découvrit les électrons ; en 1900, l'expérience de Linner découvrit que les métaux émettaient des électrons sous irradiation de lumière ultraviolette. Les gens se rendent compte que lorsque la lumière d'une certaine fréquence est irradiée sur la surface métallique, les électrons du métal absorbent l'énergie lumineuse et s'échappent de la surface métallique - l'effet photoélectrique .
(1) Expérience d'effet photoélectrique
Le schéma de montage expérimental de l'effet photoélectrique est le suivant :

Comme le montre la figure ci-dessus, la lumière brille sur la plaque métallique K à travers la fenêtre de quartz, et la plaque métallique K libère des électrons— photoélectrons . Le photoélectron atteint la plaque métallique A pour former un courant —— photocourant .
Un champ électrique V est appliqué entre les plaques métalliques A et K : lorsque (
l'énergie cinétique maximale des électrons s'échappant), aucun électron n'atteindra la plaque métallique A, et le photocourant est 0,
qui est la tension de confinement.
Résultats expérimentaux : 1) Il existe une fréquence seuil : pour tout métal, il existe une fréquence critique
. A la fréquence de la lumière incidente v>
, l'effet photoélectrique peut se produire. Lorsque v<
, quelle que soit l'intensité lumineuse, aucun photoélectron sera généré.
Elle est liée au matériau et n'a rien à voir avec l'intensité lumineuse ; 2) L'émission de photoélectrons est instantanée : quand v>
, quelle que soit la faiblesse de la lumière, les photoélectrons sont générés immédiatement (<1ns) ; 3)
Quand v > , l'intensité du photocourant i et l'irradiation L'intensité du rayonnement lumineux est proportionnelle à I , et l'intensité lumineuse n'affecte que le nombre de photoélectrons, pas l'énergie des photoélectrons ; 4) Pour le même matériau métallique, lorsque la fréquence lumineuse incidente v est constante, la tension de confinement ne change pas avec l'intensité lumineuse incidente . L'énergie des photoélectrons est liée à la fréquence de la lumière irradiée et n'a rien à voir avec l'intensité de la lumière incidente ; 5) Pour un matériau métallique spécifique, la tension de confinement
est proportionnelle à la fréquence de la lumière incidente - la lumière l'intensité n'affecte que le nombre de photoélectrons, pas l'énergie des photoélectrons. ——L'énergie des photoélectrons n'a rien à voir avec l'intensité lumineuse, mais est liée à la fréquence lumineuse .
Contrairement à la théorie originale : la physique classique considère que la lumière est une sorte de fluctuation. Si la lumière est une sorte de fluctuation, lorsque la lumière est irradiée sur des électrons, les électrons peuvent accumuler de l'énergie et s'échapper du noyau, et l'accumulation d'énergie prend temps. Ceci est contraire à l'observation selon laquelle la fréquence lumineuse est supérieure à la fuite instantanée, et l'intensité lumineuse n'affecte pas la tension de confinement. Par conséquent, une nouvelle théorie doit être proposée pour expliquer l'effet photoélectrique.
(2) Équation photoélectrique d'Einstein
Proposition de photons : En 1905, Einstein développe la théorie quantique de Planck, soulignant que la lumière existe et se propage sous forme de particules - photons . L'énergie d'un photon est . Par conséquent, dans l'effet photoélectrique, les électrons absorbent l'énergie des photons, dont une partie est consommée pour surmonter la fonction de travail des électrons, et l'autre partie devient de l'énergie cinétique après la fuite des photoélectrons . L'effet photoélectrique satisfait la relation :
La formule ci-dessus montre que pour un métal donné (avec un certain travail de sortie), l'énergie cinétique électronique T est linéairement liée à la fréquence v de la lumière incidente. La pente de la droite est h, donc pour différentes cibles, cette pente est la même.
Équation photoélectrique d'Einstein : (W est la fonction de travail, qui n'est liée qu'aux matériaux).
Caractéristiques : 1) Seuil de fréquence : l'effet photoélectrique ne se produit que lorsque v> 2) Instantané
: Lorsque les photons atteignent la surface du métal, l'énergie d'un photon est absorbée par un électron à la fois. Si v> , les électrons s'échappent immédiatement sans délai accumulation ; 3) Lorsque v> , plus l'intensité lumineuse est élevée , plus le nombre de photons est élevé, plus le nombre de photoélectrons générés par unité de temps est élevé et plus le photocourant est important .
Einstein a reçu le prix Nobel en 1921 pour l'effet photoélectrique.
2.3 Spectre
Dans l'expérience de Rutherford, la diffusion aux grands angles des particules α a confirmé l'existence du noyau, mais la distribution et le mouvement des électrons à l'extérieur du noyau restent un mystère.
(1) Principes de base et classification des spectres
Le principe de base de l'expérience du spectre : différentes longueurs d'onde de la lumière ont différents indices de réfraction dans le milieu. Sur cette base, la lumière de différentes longueurs d'onde peut être séparée pour former un spectre après que la lumière a traversé le prisme. Le spectre construit peut non seulement analyser les rayons lumineux selon différentes longueurs d'onde, mais aussi enregistrer les intensités des différentes raies spectrales.
Classification du spectre —Selon le changement de longueur d'onde, le spectre peut être grossièrement divisé en trois catégories :
1 ) Spectre continu : Il consiste en une lumière distribuée en continu de toutes les longueurs d'onde, et toute la région spectrale est lumineuse. Généralement, il est rayonné par des solides à haute température , tels que le soleil;
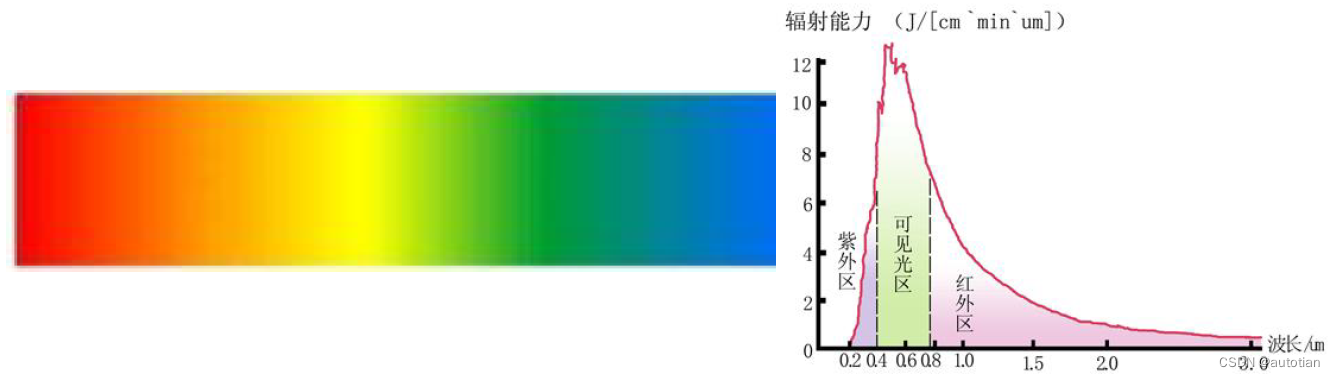
2) Spectre de bande : la longueur d'onde change continuellement dans chaque région, qui est un spectre moléculaire ;

3) Spectre de raies : la longueur d'onde change de façon discontinue (seules certaines fréquences de lumière sont émises), c'est le spectre atomique .
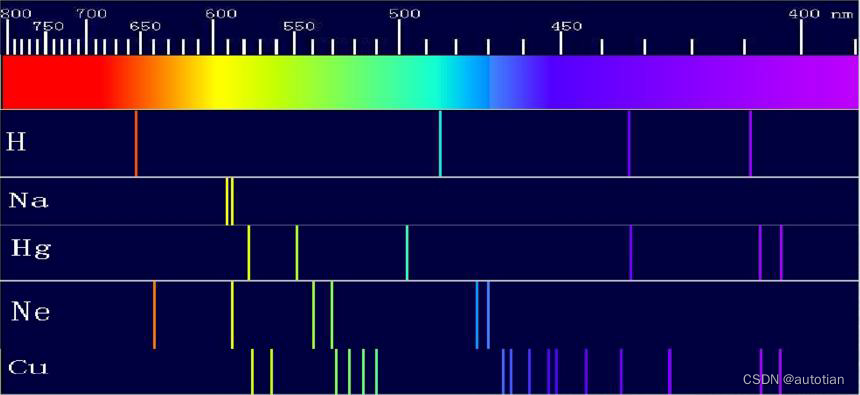
(2) Spectre atomique de l'hydrogène
Il n'y a qu'un seul électron à l'extérieur du noyau d'hydrogène, ce qui offre des conditions pratiques pour l'étude des spectres atomiques.
Phénomène expérimental : le spectre de l'hydrogène comporte de nombreuses raies spectrales dans la région visible et la région proche infrarouge, qui sont des spectres de raies discrets, et le spectre de chaque système de raies se rapproche progressivement de l'extrémité à ondes courtes du système de raies.
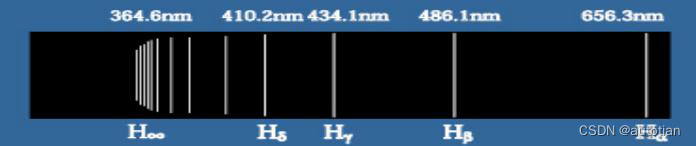
En 1885, Balmer a observé un total de 14 raies spectrales d'atomes d'hydrogène (système Balmer) à partir du spectromètre, les a analysées et a proposé une formule empirique (formule Balmer) : . Parmi eux, B = 364,56 nm est une constante empirique,
qui est l'inverse du nombre d'onde, c'est-à-dire la longueur d'onde.
En plus du système Balmer, l'atome d'hydrogène a de nombreux autres systèmes de lignes avec les mêmes caractéristiques (se déplaçant progressivement vers l'extrémité des ondes courtes - l'extrémité avec un grand nombre d'onde)
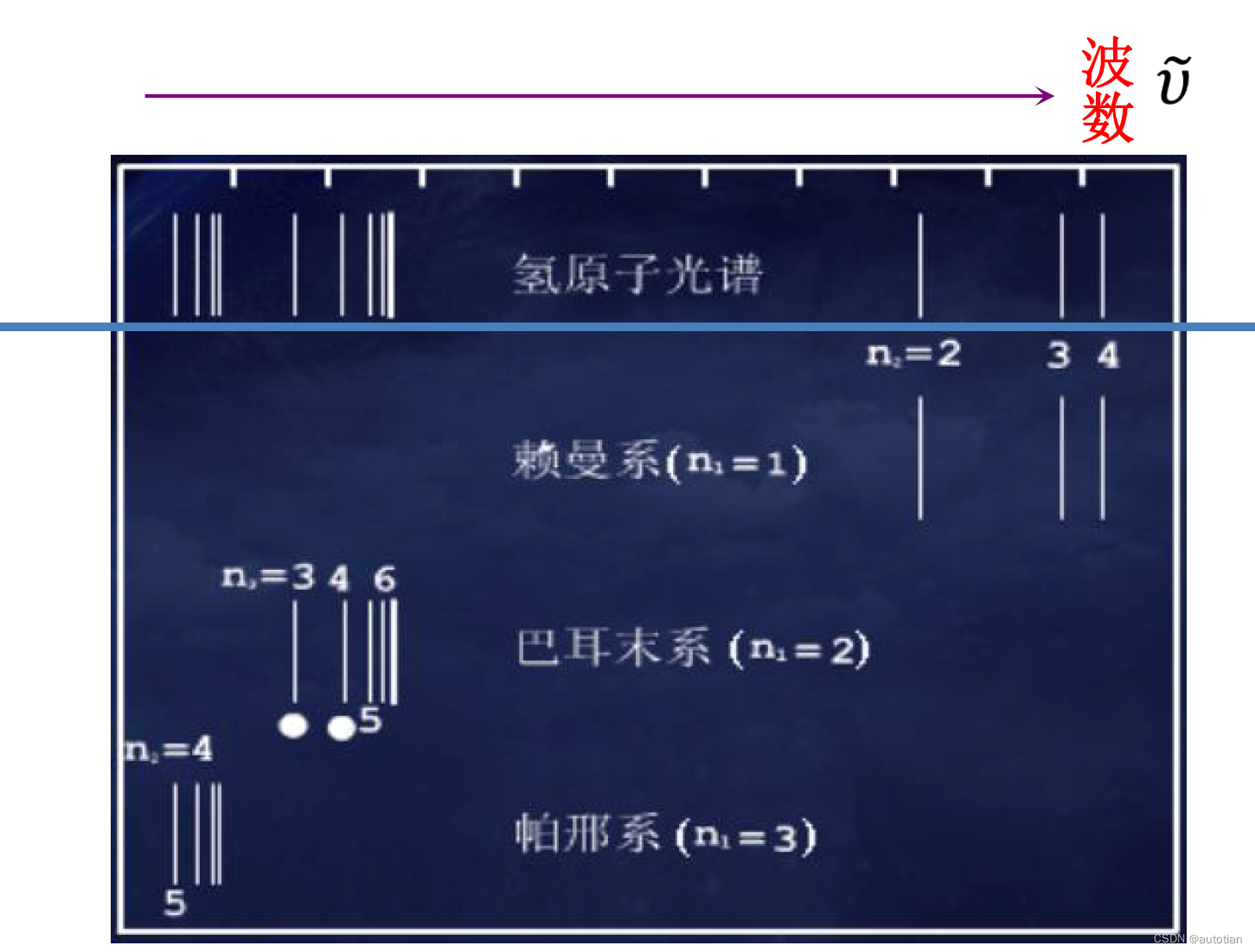
En 1889, Rydberg proposa une équation plus générale : . Parmi eux,
se trouve l'item spectral,
,
,
est la constante de Rydberg.
Règles expérimentales du spectre de l'atome d'hydrogène : 1) L'atome a un spectre linéaire ; 2) Le nombre d'onde d'une raie spectrale est déterminé par la différence entre deux éléments spectraux ; 3) La variable du premier élément spectral détermine différents pedigrees, et la variable du deuxième élément spectral Déterminer différentes raies spectrales dans le même pedigree.
Questions soulevées par l'expérience du spectre de l'atome d'hydrogène : les raies spectrales complexes peuvent être simplement exprimées par la formule de Rydberg, et la formule de Rydberg est basée sur l'expérience, ce qui peut être bien cohérent avec l'expérience. Quelle est la raison fondamentale ? La réponse sera révélée par le modèle Bohr de Bohr.
3. Modèle de Bohr
3.1. Hypothèse d'état stable
Contenu hypothétique : Le noyau électronique se déplace en cercle autour du noyau, et ne se déplace que sur des orbites discrètes . Bien qu'il y ait une accélération dans ces orbites, il ne rayonne pas d'énergie vers l'extérieur . Chaque orbite correspond à un état stationnaire, et chaque état stationnaire est lié correspondant à une énergie.
Modèle nucléaire + état stable de l'état stationnaire : 1) les électrons effectuent un mouvement circulaire autour du noyau ; 2) n'émettent pas d'ondes électromagnétiques ; 3) l'énergie de l'état stationnaire est instable.
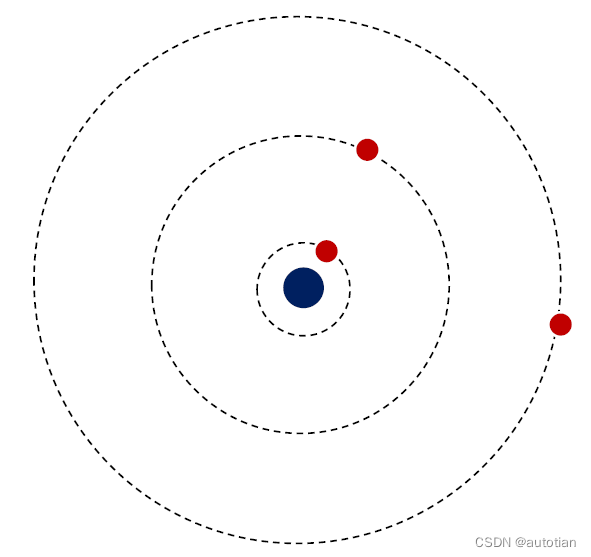
Energie électronique et fréquence de mouvement circulaire :
Selon l'hypothèse d'un état stable, les électrons se déplacent autour du noyau dans un mouvement circulaire à une vitesse uniforme. Si le noyau ne bouge pas, la force de Coulomb générée par le noyau sur les électrons fournit la force centripète du mouvement circulaire pour le électrons, à savoir :
Parmi eux, r est la distance entre l'électron et le noyau, Ze est la charge électrique nucléaire (Z est un entier positif, quand Z=1, c'est un atome d'hydrogène), et v est la vitesse linéaire de l'électron se déplaçant autour le noyau.
L'énergie électronique est générée par deux parties : l'énergie cinétique des électrons se déplaçant en cercle autour du noyau et l'énergie potentielle générée par le noyau (l'énergie cinétique des électrons quittant le noyau diminue, ce qui est une énergie potentielle négative) :
On peut obtenir que la formule d'énergie de l'électron est :
Remarque : 1) L'énergie des électrons est une valeur négative, et lorsque r tend vers l'infini, l'énergie maximale est 0. Plus le rayon r est grand, plus l'énergie E est grande et plus r est petit, plus l'énergie E est faible. 2) La discontinuité de r entraîne la discontinuité de l'énergie E.
La formule de la force centripète est fournie pour les électrons par la force de Coulomb, et la fréquence du mouvement circulaire des électrons peut être calculée :
3.2 Hypothèse de transition
Contenu hypothétique : L'électron n'est pas toujours sur une orbite, il va sauter d'une orbite stationnaire à une autre, libérant ou absorbant de l'énergie hv sous forme d'ondes électromagnétiques. (Lors du saut d'une orbite à haute énergie à une orbite à basse énergie, l'énergie excédentaire est libérée sous forme de photons ; lorsqu'une orbite à basse énergie saute vers une orbite à haute énergie, l'énergie doit être absorbée du monde extérieur )
Intérêt : Introduction de la théorie quantique de la lumière à la physique atomique.
Expression formule :
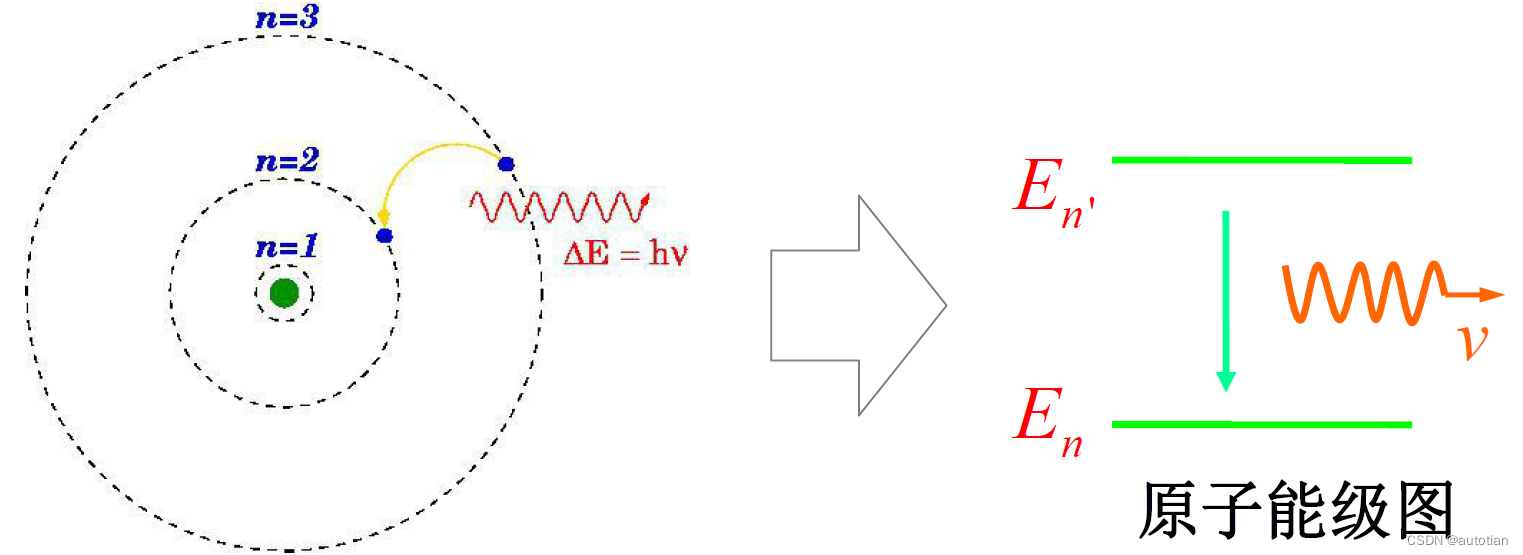
Calcul de l'énergie orbitale stationnaire :
Selon la formule de Rydberg, le nombre d'onde de l'atome d'hydrogène peut être obtenu comme : ;
Multiplier les deux côtés par hc donne :
Et puis obtenez le modèle de Bohr :
L'énergie orbitale des électrons est :
C'est-à-dire que les électrons libèrent de l'énergie et émettent des photons lorsqu'ils passent de l'état stationnaire n' à n, et la longueur d'onde des photons est λ.
Rayon orbital électronique - en combinant l'énergie orbitale stationnaire électronique mentionnée ci-dessus avec la formule d'énergie électronique en 3.1, le rayon orbital électronique peut être obtenu comme suit :
3.3 Quantification du moment cinétique
Hypothèse : Lorsque l'électron est en régime permanent, le moment cinétique est quantifié. Le moment cinétique peut être exprimé par :
, où
.
La mécanique quantique du monde microscopique et la physique classique du monde macroscopique peuvent-elles être unifiées dans certains cas ?
Sur la base de la théorie ci-dessus, nous pouvons guider que le monde microscopique peut être décrit par quantification discontinue, peu importe à partir de l'énergie ou de l'orbite des électrons. Et dans le monde macroscopique, comme le champ électrique et le champ magnétique, nous savons que l'orbite et l'énergie peuvent changer en permanence. La révolution périodique des objets chargés émettra un spectre continu et la fréquence de rayonnement est égale à la fréquence de révolution .
Une théorie quantique des phénomènes atomiques devrait donner les mêmes résultats à la limite que la physique classique correspondante
Autrement dit, lorsque le nombre quantique est grand et que le changement est petit, le résultat de la théorie quantique devrait être similaire au résultat de la physique classique, et vice versa.
1) Etat de variation continue du niveau d'énergie :
Selon la condition de fréquence , lorsque
la différence entre n et n' est très petite, le niveau d'énergie est dans un état de changement continu, le comportement du système quantique tendra vers le système classique, et la loi classique est valable ;
2) La fréquence du rayonnement quantique se rapproche de la fréquence du rayonnement classique :
A ce moment ,
, la fréquence de transition quantique peut être approchée comme suit :
Dans la théorie classique, les particules chargées effectuent un mouvement périodique et la fréquence du rayonnement émis en continu = la fréquence du mouvement périodique des particules. En combinant avec la fréquence du mouvement circulaire des électrons en 3.1 :
En supposant que la fréquence de transition quantique est égale à la fréquence du mouvement circulaire, les deux formules ci-dessus peuvent être combinées pour obtenir le rayon orbital de l'électron :
Simultanément avec la formule du rayon orbital de 3,2 électrons , l'expression de la constante de Liberd peut être obtenue :
Calculé pour obtenir :
La constante de Rydberg obtenue expérimentalement est :
Résultats théoriques : La différence entre les constantes théoriques et empiriques est de cinq dix millièmes. La différence de 5/10 000 est aussi l'une des vérifications expérimentales du modèle de Bohr proposées plus tard.
Dérivation de la formule de quantification du moment angulaire orbital :
Ramenez-le à nouveau , vous pouvez obtenir
(où,
).
Alors la force centripète est fournie par la force de Coulomb 3.1 : , on peut obtenir
À partir des expressions de la somme et ci-dessus, le moment cinétique
orbital peut être calculé comme suit :
On peut voir à partir de la formule ci-dessus que le moment cinétique est également quantifié.